 10% vun de Patienten mat GERD entwéckelen Barrett d'Speiseröh, e Risikofaktor fir Kriibs vun der Speiseröh.
10% vun de Patienten mat GERD entwéckelen Barrett d'Speiseröh, e Risikofaktor fir Kriibs vun der Speiseröh.

Barrett d'esophagus huet keng eenzegaarteg Symptomer. Patienten mat Barrett hunn d'Symptomer vun GERD oder Seier reflux enthält déi folgend:
Barrett d'esophagus ass eng Komplikatioun vun chronescher gastroesophageal reflux Krankheet (GERD), virun allem an wäiss Männer. GERD ass eng Krankheet an där et Reflux vu sauerem Flëss aus dem Magen an d'Speiseröh ass (de Schluckröhre). GERD verursaacht meeschtens Heartburn.
Et ginn zwou Ufuerderunge fir d'Diagnostik vum Barrett's Speiseröh. D'Ufuerderunge erfuerderen eng Endoskopie vun der Speiseröh. Wärend der Endoskopie gëtt e laange flexibelen Röhre mat engem Liicht a Kamera um Tipp (en Endoskop) duerch de Mond a erof an d'Speiseröhre agefouert fir d'Biopsie (Probegewebe aus) d'Speiseröhre ze gesinn. Déi zwee Ufuerderunge sinn:
Dem Barrett seng Speiseröh ass offiziell vun der Library of Congress fir elektronesch Recherche vun der Literatur als Barrett Speiseröh kodéiert, awer dem Barrett seng Speiseröh (mat der Apostroph "s") ass den Numm deen allgemeng benotzt gëtt. D'Konditioun ass no engem Chirurg benannt, Norman Barrett, deen d'Konditioun beschriwwen huet. Wéi och ëmmer, et stellt sech eraus datt seng Interpretatioun vun den Erkenntnisser net richteg war. Am Joer 1953 hunn d'Dokteren Allison an Johnstone dës Bedingung tatsächlech beschriwwen wéi mir et elo verstinn, nämlech datt d'Metaplasie geschitt ass. (Metaplasia, déi hei ënnen diskutéiert gëtt, ass de Begrëff, deen benotzt gëtt wann een erwuessene Tissu en aneren ersetzt.) Trotzdem ass d'Konditioun mam Barrett sengem Numm veréiwegt ginn.
Am Ufank gouf geduecht datt d'Barrett-Speiseröh aus Mo (gastric) Otemschwieregkeeten bestoung, deen den üblechen squamous Tissue vun der Speiseröh ersetzt. Wéi och ëmmer, an der Mëtt vun de 70er hunn den Dr Paull a seng Kollegen e Pabeier publizéiert, an deem se d'Schleimhaut (bannenzeg Beleidegung) vum Barrett seng Speiseröh méi detailléiert beschriwwen hunn wéi virdru gemaach. Si hunn drop higewisen datt dem Barrett seng Speiseröh aus enger Metaplasie bestoung, an där déi normal Zellen, déi d'Speiseröhne leeën, duerch eng Mëschung aus Magen- an Darmzellen ersat goufen. D'Darm-Typ Beleidegungszellen ginn och spezialiséiert Kolonnzellen genannt, déi Becherzellen enthalen. Fir eng Rei vu Joer, puer Wëssenschaftler geduecht, datt et zwou Zorte vu Barrett d'; eent an deem déi normal Doropshin mat Mo (gastric) Typ Zellen ersat nëmmen, an déi zweet an deem intestinal Zellen präsent waren. Wéi och ëmmer, déi aktuell Iwwerzeegung ass datt nëmmen d'Präsenz vun Darm-Typ Becherzellen d'Diagnostik vum Barrett's Speiseröh feststellt, egal wéi eng aner Zellarten präsent sinn.
De Grond fir de groussen Interessi un der Speiseröh vum Barrett ass datt et mat engem erhéicht Risiko vu Kriibs vun der Speiseröh assoziéiert ass. D'Art vu Kriibs, déi bei Patienten mat Barrett's geschitt ass Adenokarzinom, deen aus dem metaplastesche Darmgewebe entstinn. Den üblechen Kriibs vun der Speiseröh, deen net mat Barrett ass assoziéiert ass Plateaukarzinom, deen aus der Plateauzellbeleidegung entsteet, déi normalerweis an der Speiseröh präsent ass. D'Verbindung tëscht Adenokarzinom vun der Speiseröh an der Speiseröh vum Barrett ass elo kloer, an Adenokarcinom vun der Speiseröh ass an de meeschte Länner an der westlecher Hemisphär eropgaang.
D'Gutt Noriicht ass awer datt de Kriibs a relativ wéinege Patienten mat Barrett's Speiseröh geschitt. Trotzdem ass d'Haaptfuerderung an dësem Zoustand fir fréi Warnungszeeche vu Kriibs ze kucken andeems Dir Biopsien a reegelméissegen Intervalle wärend der Endoskopie huelen. Dës Praxis gëtt Iwwerwaachung genannt an ass am Prinzip ähnlech wéi d'Iwwerwaachung bei Frae fir Gebärmutterkriibs, wou PAP-Schmieren a regelméissegen Intervalle geholl ginn.
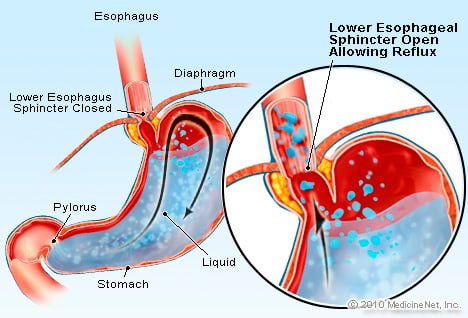
 GERD ass eng Bedingung an där exzessive sauerhaltege Flëssegkeetsrefluxen (fléisst) zréck an d'Speiseröhre, deelweis well den ënneschten esophageal sphincter ass schwaach.
GERD ass eng Bedingung an där exzessive sauerhaltege Flëssegkeetsrefluxen (fléisst) zréck an d'Speiseröhre, deelweis well den ënneschten esophageal sphincter ass schwaach. GERD bewierkt Barrett d'esophagus. D'esophagus ass e muskuläre Rouer, deen an der Këscht läit an déngt fir Liewensmëttel aus dem Mond an de Mo ze transferéieren. Den ënneschten Speiseröhre Sphincter (LES) ass e Ventil deen op der Kräizung vum Magen mat der Speiseröh läit. Seng Funktioun ass Seier an aner Inhalter vun de Mo ze verhënneren aus zréck an d'esophagus kommen. GERD ass eng Bedingung an där exzessive sauerhaltege Flëssegkeetsrefluxen (fléisst) zréck an d'Speiseröhre, deelweis well den ënneschten Speiseröhre Sphincter schwaach ass. D'Schwächheet vun der LES kann deelweis mat der Tatsaach verbonne sinn datt praktesch all GERD Patienten hiatal Hernia hunn. Bei Patienten mat Hiatal Hernia rutscht déi iewescht Zentimeter vum Magen zréck an zréck tëscht dem Bauch an der Këscht duerch d'Membran. Dëse Rutsch kann interferéieren wéi de Sphincter funktionnéiert als Barrière fir de Reflux vum Magen an d'Speiseröh.
Virdru gouf de Begrëff Hernia amplaz GERD benotzt fir Patienten d'Basis vun hire Symptomer z'erklären (normalerweis Heartburn), well praktesch all GERD Patienten hiatal Hernias hunn. GERD ass awer de méi genaue Begrëff. Während Hiatal Hernia extrem heefeg an der Bevëlkerung sinn, entwéckelen nëmmen eng kleng Unzuel vu Leit mat Hiatal Hernia GERD. An anere Wierder, d'Präsenz vun enger hiatal Hernia heescht net datt d'Persoun GERD entwéckelt. Op der anerer Säit, awer, wann eng Persoun GERD huet, ass hiatal Hernia bal ëmmer präsent.
Also, Barrett d'esophagus ass duerch chronescher (vu ville Joer Dauer) verursaacht an normalerweis schwéieren Seier reflux. An e puer Patiente mat GERD reagéiert d'Speiseröh op déi widderholl Verletzung vun der saierer Flëssegkeet andeems d'Zort vun Zellen aus squamous (normalen Zellen) op Kolumnär (Darm-Typ Zellen) verännert. Dës Transformatioun, genannt Metaplasie, gëtt ugeholl datt et eng Schutzreaktioun ass, well de spezialiséierte columnar Epithel (Epithel heescht Fuedem) an der Speiseröh vum Barrett méi resistent géint Verletzung vu Säure ass wéi de squamous Epithel.
D'Flëssegkeet am Magen enthält Säure déi vum Magen produzéiert gëtt. Zousätzlech kann d'Flëssegkeet awer Gallensäuren enthalen (vu Galle produzéiert vun der Liewer) an Enzymen (produzéiert vun der Bauchspaicheldrüs), déi aus dem Duodenum an de Mo. (Den Duodenum ass den éischten Deel vum Dënndarm just iwwer de Mo.) D'Säure, déi vum Magen an d'Speiseröhre refluxt, ass schiedlech fir d'Speiseröhn. Et gëtt awer e puer Beweiser, datt d'Gall- an d'Bauchspaicheldrüs Enzyme kombinéiert mat der Säure méi schiedlech kënne sinn wéi Säure eleng.
E bedeitende Prozentsaz vun Individuen mat chronesche Symptomer vun GERD entwéckelen Barrett d'esophagus, an et ass am meeschte gemeinsam an Caucasian männlech Populatiounen. Net jiddereen mat GERD huet awer Symptomer vu GERD. Dofir sinn e puer Leit mat Barrett's net bewosst datt se Barrett's hunn, well se GERD ouni Symptomer hunn oder ganz mëll an selten Symptomer hunn.
Et ass net kloer firwat dem Barrett seng Speiseröh sou iwwerwältegend méi heefeg ass bei wäiss Männercher wéi an all aner Grupp. Zum Beispill, obwuel Fraen an Afro-Amerikaner schéngen net vun der Entwécklung vun GERD geschützt ze sinn, si si gréisstendeels geschützt (besonnesch Afro-Amerikaner) vun der Entwécklung vum Barrett-Speiseröh a Barrett-Kriibs (Adenocarcinom). Et gëtt Beweiser datt an der westlecher Hemisphär, Speiseröhkriibs a Kriibs vun der gastroesophagealer Kräizung (genannt Kardiakriibs) an der Frequenz eropgoen, vläicht méi wéi all aner Magen-Darmtraktkriibs. (Allerdéngs ass Colon Kriibs nach ëmmer vill méi heefeg wéi Speiseröhkriibs.)
Barrett d'esophagus kann an e puer Famillen lafen a genetesch determinéiert ginn. Studien sinn amgaang ze bestëmmen ob Genen oder Markéierer an dëse Familljen fonnt kënne ginn, déi d'Entwécklung vum Barrett's Speiseröh an der allgemenger Bevëlkerung viraussoen. An dëse Familljen mam Barrett wéi och mam Barrett an der allgemenger Bevëlkerung ass GERD de gemeinsame Nenner. Wéi och ëmmer, d'Fro ass firwat d'Barrett's méi heefeg an dëse Familljen optriede wéi an anere mat vergläichbar schwéieren GERD, awer ouni Familljeassociatioun.
Fir ze widderhuelen, den éischte Critère fir d'Diagnos vum Barrett's Speiseröh ass d'Entdeckung bei der Endoskopie vun enger rosa Fusioun an der Speiseröh, wou et normalerweis net gesi gëtt. Dës anormal Fusioun kann circumferentially wéi eng Band, Zong-ähnlech oder als Inselen erschéngen. Den zweete Critère ass datt Biopsien aus der rosa Fusioun déi charakteristesch intestinaliséierter Schleimhaut (d'Fusioun déi normalerweis am Darm gesi gëtt) mat den typesche Becherzellen entdecken. D'esophageal Biopsie gi während enger Endoskopie kritt. Eng iewescht gastrointestinal Endoskopie ass eng Prozedur, an där den Dokter e laange flexibelen Röhre (Endoskop) duerch de Mond an erof an d'Speiseröhre setzt fir d'Speiseröhre direkt ze visualiséieren. Wärend der selwechter endoskopescher Untersuchung kënnen de Mo an den Duodenum och visualiséiert ginn. Multiple kleng Echantillon (Biopsies) vun der Doropshin epithelial Otemschwieregkeeten kann duerch d'endoscope kritt ginn.
Wéi virdru scho gesot, gëtt de Prozess vum Ersatz vun enger Aart vun Tissuebeleidegung duerch eng aner Metaplasie genannt. Am Magen an Darm ass Metaplasie eng gemeinsam Äntwert op verschidden Zorte vu Verletzungen. Wéi den Henry Appelman, e Patholog, sot:"Wann den Darm ënner Stress ass, wëll et eppes anescht sinn." Aner Beispiller vun metaplasia an deem eent Doropshin ersetzt aner sinn:(1) am Mo wou chronescher inflammation (gastritis) an engem intestinal-Typ Doropshin Resultat kann Deeler vun der normal Mo Doropshin ersat; an (2) am Duodenum (just iwwer de Mo am Darm) wou peptesch Geschwëster optrieden an d'Darmschicht ronderëm de Geschwëster transforméiert an eng Bauch-Typ Fuedem.
Mir gleewen datt de Prozess vun der Metaplasie eng schützend oder adaptiv Äntwert op d'Verletzung vun der Fusioun ass. Wéi och ëmmer, den Nodeel vun der Metaplasie ass datt an der Speiseröh vum Barrett eng kleng awer definitiv Erhéijung vum Risiko fir kriibserreegend ze ginn. Net all Metaplasien hunn e erhéicht Risiko vu Kriibs. Zum Beispill, vun den zwou Metaplasien, déi am virege Paragraphe bezeechent ginn, kann d'Darmmetaplasie am Magen zu Kriibs féieren, awer d'Darmmetaplasie am Duodenum net.
De Prozess vun der Entwécklung vum Barrett fänkt un der Kräizung vum Magen an der Speiseröhlinn. D'Speiseröh ass normalerweis vun engem squamous Epithel oder Fudderschicht bedeckt. Dëst squamous Epithel huet e pärelwäiss Erscheinung, wärend d'Fusioun am Mo an Darm eng méi Saumonrosa Faarf huet well et e columnar Epithel ass anstatt e squamous Epithel. De squamous Epithel besteet aus flaach squamous Zellen, déi ähnlech wéi Hautzellen sinn. De Mo oder gastric Doropshin besteet aus méi grouss columnar Zellen wéi ënnert dem microscope gesinn. D'Kräizung vum squamous Epithel vun der Speiseröh an dem Magenkolonnepithel geschitt op der Kräizung vun der Speiseröh a Magen, wou, wéi Dir Iech erënnert, den ënneschten Speiseröhresphincter läit. Déi gemeinsam Grenz (Interface) vun dësen zwou Linnen gëtt dacks als Z-Linn bezeechent, well wann se während enger Endoskopie ënnersicht gëtt, huet se e Zick-Zack-Erscheinung.
Mat progressiver Verletzung vun der Speiseröh geschitt Metaplasie an de metaplastesche Tissue bewegt d'Speiseröh op eng Distanz déi vu Persoun zu Persoun variéiert, normalerweis vun ongeféier 0,5 bis 2,5 Zoll (ongeféier 1 bis 6 Zentimeter). D'Zort vun der Zell déi de metaplastesche Tissu entsteet ass net bekannt.
D'Barrett Speiseröh ass dacks a Kuerz- oder Langsegment Barrett's kategoriséiert, baséiert op der Längt vun der Speiseröh déi betraff ass. Kuerz Segment Barrett bezitt sech allgemeng op Engagement vun 3 Zentimeter oder manner, während laang Segment bedeit Engagement vu méi wéi 3 Zentimeter vun der Speiseröh. Interessanterweis, wann d'Speiseröhne vum Barrett an engem Patient diagnostizéiert gëtt, schéngt d'metaplastesch Fusioun net weider an d'Speiseröhre ze progresséieren wann de Patient fir GERD behandelt gëtt. Also, mat der Zäit, bleift d'Längt vun der Bedeelegung mam Barrett allgemeng d'selwecht.
Wann Biopsie vu Patienten mat GERD geholl ginn, déi eng normal Erscheinung Z-Linn hunn (keng siichtbar Beweiser fir Barrett-Speiseröhre), bis zu 30% weisen déiselwecht Darm-Typ Metaplasie mat Becherzellen wéi déi, déi an der Barrett-Speiseröhre gesi ginn. Wéi och ëmmer, mir Biopsie net routinéiert normal erschéngen Z-Zeilen fir no dëser Ännerung ze sichen, a mir iwwerwaachen och net wa mir et do fannen. De Grond ass datt limitéiert intestinal Metaplasie vun der gastroesophagealer Kräizung Regioun an GERD mat enger ähnlecher Frequenz bei Fraen an Afroamerikaner schéngt wéi bei wäisse Männer ze geschéien, awer de Risiko vun der Barrett Speiseröh ass vill manner wéi bei wäisse Männer.
Dofir sollt d'Präsenz vu Metaplasie op enger Routine Biopsie vun enger normaler Erscheinung Z-Linn am GERD net zu enger Verännerung vun der Gestioun féieren. Wat méi ass, d'Entdeckung vu Becherzellen an dësem Kontext sollt net als Ultrashort Segment Barrett's bezeechent ginn, wéi e puer virgeschloen hunn. Den Haaptgrond fir et net als Barrett's ze markéieren ass datt de Begrëff Barrett's e erhéicht Risiko vu Kriibs implizéiert, an et gëtt keng Beweiser datt dës Erkenntnis mat engem erhéicht Kriibsrisiko assoziéiert ass.
D'Art vu Kriibs, déi mam Barrett's Speiseröh geschitt ass Adenokarcinom. Kriibs entstinn aus der squamous Fuedem vun der esophagus squamous Kriibs oder carcinoma genannt. Ënner de Kaukasier ass den Taux (Frequenz iwwer Zäit) vu Plateaukrebs erofgaang relativ zum Barrett-assoziéierten Adenokarcinom. Aner Rassegruppen (zum Beispill Afroamerikaner) hunn awer net deeselwechten Taux vum Réckgang am Plateaukrebs par rapport zu Adenokarzinom erlieft.
Fëmmen an exzessiv Alkoholkonsum sinn definitive Risikofaktoren fir Plateaukrebs. Si sinn och Risikofaktoren fir Adenokarzinom an der Speiseröh vum Barrett gesinn. An dëser Situatioun ass et awer net kloer ob Fëmmen an Alkohol de Risiko fir Adenokarzinom erhéijen andeems GERD méi schwéier gëtt oder wann Fëmmen an Alkohol e méi direkten kriibserreegend Effekt hunn, wéi et am Plateaukrebs geschitt. Squamous Zell Cancers sinn ëmmer manner heefeg ginn, während Adenokarzinom Diagnosen eropgaange sinn. Adenocarcinoma Heefegkeet bei wäiss Männercher ass méi steil geklommen wéi an anere ethneschen Gruppen.
Am ganzen Rescht vun dëser Rubrik wäert de Begrëff Speiseröhkriibs op Adenokarcinom bezéien, deen aus der Speiseröh vum Barrett entstinn.
Kriibs vun der gastroesophageal Kräizung ass och Cardia Kriibs genannt well d'Regioun wou d'esophagus de Mo meets ass Cardia genannt. Dëse Kriibs, wéi dem Barrett assoziéierten Adenokarcinom, gëtt haaptsächlech a wäiss Männercher fonnt, ass anscheinend an der Frequenz eropgaang am selwechten Taux wéi Speiseröhrekriibs, an ass mat chronescher GERD assoziéiert. Dofir gouf spekuléiert datt Kardiakriibs vu kuerze Segmenter (zum Beispill 1-2 cm) vu Barrett fänkt. No der Zäit wou d'Diagnostik vu Kriibs gemaach gëtt, kann den Tumor awer iwwer de kuerze Segment vum Barrett's verbreet sinn a ka schéngen an der Cardia ze sinn. Dës Spekulatioun iwwer den Urspronk vum Kriibs vun der Cardia bleift awer nach ze beweisen.
Eng Erhéijung vun der Frequenz vum Speiseröhre Adenokarzinom gouf fir mindestens 20 Joer beobachtet, virun allem bei wäiss Männercher. Ee Hiweis zum Grond fir dësen Trend kann mat enger Ofsenkung vun der Frequenz vun H. pylori Infektioun vun de Mo. An anere Wierder, Leit mat Barrett Kriibs, dorënner Cardia Kriibs, schéngen manner Tariffer vun H. pylori Infektioun wéi anerer vum selwechten Alter a Geschlecht an der selwechter Bevëlkerung.
H. pylori ass eng Aart vu Bakterien déi eng grouss Ursaach vu Geschwüren ass. Et ass eng ganz heefeg Infektioun weltwäit a verursaacht keng Symptomer an der grousser Majoritéit vu betraffene Leit. Wéi och ëmmer, e puer Leit mat H. pylori entwéckelen peptesch Geschwüre vum Magen an Duodenum. Dës Geschwüre ginn behandelt andeems d'Bakterien eliminéiert ginn, wat am Tour de Réckwee vun de Geschwüren verhënnert.
Wann H. pylori geet onbehandelt, et bewierkt progressiv inflammation vun de Mo (gastritis), déi mat Reduktioun vun Seier secretion an eventuell manner reflux vun Seier an der esophagus assoziéiert ass. A ville Beräicher vun der Welt geet dës Infektioun an der Frequenz erof, viraussiichtlech wéinst bessere ëffentleche Gesondheetsmoossnamen. Dofir ass et méiglech datt de Schutzeffekt (wéi eng reduzéiert Säureproduktioun) vu chroneschen H. pylori Infektioun ass ofgeholl. An anere Wierder, mat manner H. pylori gastritis, de Mo produzéiert méi Seier an et gëtt méi Seier zu reflux an der esophagus. Zur selwechter Zäit si mir méi predisponéiert fir Reflux an eise Senioren. Och wann dëst net e geléist Thema ass, ass d'Ofsenkung vun der Frequenz vun H. pylori Infektioun kann ee Grond sinn fir d'Erhéijung vun der Frequenz vum Barrett-assoziéierten Adenokarcinom.
Dysplasie ass eng Verännerung vun den Zellen, déi d'Speiseröhre beliichten, an deenen d'Zellen tatsächlech anormal Verännerungen an hirer Struktur an Erscheinung weisen. Wann dës Verännerunge schwéier genuch ginn, (vu Low-Grad zu High-Grad Dysplasie goen) fänken d'Zellen bösarteg op (wéi Kriibszellen). Wéi och ëmmer, am Géigesaz zu Kriibs bleiwen dës Zellen op der Plaz an iwwerfalen net Stoffer ausserhalb vun der Fusioun. Dysplasie geschitt als eng Serie vun Zell Ännerungen wéi Barrett d'esophagus Fortschrëtter zu Barrett d'assoziéiert Kriibs. Patienten mat Barrett ginn iwwerwaacht mat Endoskopie a Biopsien (Iwwerwaachung) fir dës cellulär Verännerungen (d'Dysplasie) oder am schlëmmste fréie Kriibs z'entdecken, fir datt se behandelt kënne ginn. Momentan gëtt et kee Wee fir virauszesoen, wéi eng Patienten mat der Barrett-Speiseröhre Dysplasie entwéckelen.
Dysplasia gouf och nieft Tumoren vum Magen-Darmtrakt ausser Speiseröh Adenocarcinom identifizéiert. Zum Beispill gëtt Dysplasie an der Halschent vun de Fäll vu Bauchkriibs a Colonkrebs fonnt, an deenen d'Dysplasie als sougenannte adenomatöse Polypen sichtbar ass. Zousätzlech ass Dysplasie déiselwecht fréi Warnungszellverännerung, déi Pathologen no bei PAP-Schmieren vum Gebärmutterhalskrank sichen, déi Gebärmutterkriibs viraussoen.
Dysplasie gëtt als premalignant ugesinn. Dëst bedeit datt wann d'Dysplasie e puer Mol bewisen ass, gëtt ugeholl datt de Patient Kriibs entwéckelen wann hien oder hatt laang genuch lieft. Dysplasie ass kategoriséiert als héich oder niddereg Grad. Wann héichwäerteg Dysplasie diagnostizéiert gëtt, kann Kriibs scho präsent sinn, a wann net, ass de Risiko fir Kriibs méi fréi z'entwéckelen méi grouss wéi mat de mannere Graden vun Dysplasie.
Bei Suivi-Biopsie vu Patienten mat Dysplasie kann d’Conditioun an e puer Patienten net erëm erkannt ginn, wärend an aneren niddereg Graden vun Dysplasie fonnt ginn. Dës Fehlen oder Ofsenkung vun der Dysplasie kann duerch Faktoren wéi Probenvariatioune sinn, d'Entfernung vu klenge Foci (Zellgruppen) vun der Dysplasie mat der initialer Biopsie oder tatsächlech biologescher Réckgang. Déi genee Ursaach(e) sinn onbekannt.
Mat molekulare Techniken kënnen e puer Ännerungen, déi als Biomarker bezeechent ginn, a Biopsie-Exemplare festgestallt ginn ier d'Dysplasie entwéckelt. Dës Ännerungen sinn ähnlech wéi déi, déi an anere Kriibs observéiert ginn. Biomarker enthalen Ännerungen am DNA Inhalt vun Zellen, an Genen a Chromosomen, a Wuesstumsfaktoren. Eng Zuel vun dëse Biomarker kënne gewise ginn ier a während dem Optriede vun Dysplasie ze erschéngen. D'ultimativ Zil ass e magesche Marker ze fannen deen eis kann soen wéi eng Patienten ënner deenen ouni Dysplasie oder niddereg Grad Dysplasie méi wahrscheinlech héichgradeg Dysplasie oder Kriibs entwéckelen. Esou Patienten kënnen dann duerch Iwwerwaachung méi no gefollegt ginn wéi anerer.
Am Moment sinn all Patienten mat Barrett d'esophagus, aus der Iwwerwaachung Siicht, an déi selwecht Manéier behandelt. D'Disponibilitéit vu Biomarker géif dem Barrett seng Patienten trennen (stratifiéieren) baséiert op hirem Risiko fir Kriibs. Esou Stratifikatioun géif d'Dokteren erlaben Iwwerwaachungsendoskopie a Biopsie méi dacks an der Minoritéit vu Patienten ze maachen, déi e méi grousse Risiko vu Kriibs hunn a manner dacks bei deenen, déi virausgesot sinn e méi nidderegen Kriibsrisiko ze hunn.
Eng aner Notzung fir bewährte Biomarker wier ze hëllefen d'Interpretatioun vum Patholog vun der Dysplasie op Biopsien ze bestätegen.
Wann Patienten mat Barrett d'esophagus als Grupp bewäert ginn, ass de Risiko vu Kriibs esou niddereg wéi een an 300 Patienten all Joer fonnt. Dëst bedeit datt wa mir all Joer 300 Patienten ënnersicht, ee Patient all Joer Kriibs hätt. Wat mir wierklech musse wëssen ass de Risiko vu Kriibs wa keng Dysplasie no engem oder zwee Joer Iwwerwaachung fonnt gëtt. Eis Iwwerzeegung ass datt dëse Risiko vill manner wier wéi déi virdru zitéiert Zuelen vun engem op 300 Patienten all Joer.
Patienten mat héije Grad Dysplasie kënnen dacks Kriibs fonnt ginn. Dofir ass déi éischt Uerdnung vun der Gestioun wann héichgradeg Dysplasie fonnt gëtt d'Präsenz vun engem Adenokarcinom auszeschléissen.
Niddereg Grad Dysplasie ass vill manner bedrohend wéi Héichgrad Dysplasie, awer mir wëssen net wéi vill manner. Tatsächlech hu mir keng präzis Daten fir unzeweisen wat de Kriibsrisiko bei Patienten mat Barrett a Low-grade Dysplasie ass.
D’Diagnostik vun der Dysplasie soll esou präzis wéi méiglech sinn, well dës Diagnostik kann eng Verännerung vun der Behandlung oder der Intensitéit vum Suivi vu Patienten mat der Barrett-Speiseröh maachen. Et erfuerdert vill Erfahrung fir eng präzis Diagnostik vun der Präsenz an der Grad vun der Dysplasie ze maachen. Dofir ass et eng allgemeng an nëtzlech Praxis fir en zweete Patholog (oder souguer en Drëttel, wann néideg) ze froen fir d'Biopsie ze iwwerpréiwen. D'Iddi ass ze kucken ob et en Accord tëscht de Pathologen ass an / oder eng méi erfuerene Meenung iwwer d'Präsenz an d'Grad vun der Dysplasie ze kréien.
Wann eng Persoun méi laang Segment Barrett's huet, géif ee roden datt de Kriibsrisiko méi grouss ass wéi mat méi kuerzer Segment Barrett's. D'Daten sinn awer kontrovers an dëser Hisiicht. Aus deem Grond ass déi aktuell Praxis endoskopesch Biopsie Iwwerwaachung mat ähnlecher Frequenz bei Patienten mat kuerzen a laange Segment Barrett's Speiseröh ze maachen.
Barrett d'esophagus huet keng eenzegaarteg Symptomer. Patienten mat Barrett d'Symptomer vun GERD (zum Beispill, heartburn, regurgitation, benotzen, etc.). Den allgemengen Trend ass datt dem Barrett seng Patienten méi schwéier GERD hunn. Wéi och ëmmer, net all Barrett hunn Symptomer vu GERD markéiert, an e puer Patiente ginn zoufälleg mat minimalen oder guer keng Symptomer vun GERD festgestallt.
Heartburn ass eng brennend Sensatioun hannert der Broscht, normalerweis an der ënneschter Halschent, awer kann bis an den Hals verlängeren. Heiansdo gëtt et begleet vu Brennen oder Péng am Pit vum Magen just ënner wou d'Brustbeen endet. Dat zweet heefegste Symptom ass d'Regurgitatioun (Backup) vu bitter schmaache Flëssegkeet. GERD Symptomer sinn dacks méi schlëmm nom Iessen a wann se flaach leien.
Déi refluxéiert, regurgitéiert Flëssegkeet kann heiansdo an d'Lunge oder d'Stëmmkëscht (Keelt) erakommen, wat zu deem wat extraesophageal genannt gëtt (ausserhalb vun der Speiseröh) Symptomer (Manifestatiounen) vu GERD. Dës Symptomer enthalen:
Aus Grënn, déi net ganz verstanen sinn, hunn e puer GERD-Patienten minimal Sodbrennen, awer erliewen aner GERD-Symptomer, zum Beispill extraesophageal Symptomer.
GERD kann zu Strikturen a Geschwüre vun der Speiseröh féieren. Eng Striktur oder Verengung ass wéinst Narben (Fibrose) vun der Speiseröh, déi Schwieregkeete beim Schlucken verursaache kann (Dysphagie). D'Dysphagie gëtt gesi wéi e Stéck (stoppen) vu festen Iessen an der Këscht (an der Speiseröh), a Flëssegkeeten wann d'Verengung schwéier ass. Strikturen kënne behandelt ginn andeems se se mat Dilatatoren während der Endoskopie strecken. Onbehandelt, Strikturen kënne méi Spillage vu Liewensmëttel an / oder Magenflëssegkeeten an d'Lunge förderen. Selten, massiv gastrointestinal (GI) Blutungen verursaacht duerch Entzündung vun der Speiseröh kann optrieden. Esou Blutungen entstoen zu Erbrechung vum Blutt oder Passage vu schwaarzen oder maronen Hocker. Méi heefeg, awer, en entzündte Speiseröh kann lues Blutungen verursaachen, déi festgestallt ginn wann Anämie (eng niddereg Zuel vu roude Bluttzellen) fonnt gëtt an / oder Hocker fir Blutt getest ginn.
D'medizinesch Behandlungen fir d'Symptomer vum Barrett's Speiseröh sinn déiselwecht wéi déi fir GERD.
D'Ënnerdréckung vu Säure ass de Pilier vun der Behandlung fir GERD. Fir mëll reflux Symptomer, iwwer-de-Konter Medikamenter sinn allgemeng benotzt, rangéiert vun antacids zu niddereg Dosen vun Drogen genannt H-2 Rezeptor antagonists oder H2 blockers. Beispiller vun iwwer-de-Konter H2 Blocker sinn Cimetidin (Tagamet) a Famotidin (Pepcid, Zantac 360). Fir méi persistent Symptomer kënne méi héich (Rezeptstäerkt) Dosen vun den H-2 Rezeptor Antagonisten Medikamenter benotzt ginn, zum Beispill:
Wéi och ëmmer, fir persistent Symptomer, déi Ënnerhalt (laang) Therapie erfuerderen oder fir komplizéiert GERD mat Strikturen oder Blutungen, ginn Protonpompel Inhibitoren (PPIs) benotzt. Beispiller vu PPIs sinn:
E puer Patiente brauchen nëmmen eng Pille all Dag ze huelen, anerer brauchen zwou Pëllen (eng duebel Dosis) fir d'Symptomer ze kontrolléieren. Déi duebel Dosis kann als eng Pille zweemol am Dag oder 2 Pëllen eemol am Dag geholl ginn.
PPIs sinn mächteg inhibitors vun Seier secretion aus dem Mo. Si sinn effektiv fir Heartburn ze entlaaschten an ze heelen Speiseröhnentzündung (Speiseröhne) an Speiseröhregeschwüren, déi duerch Seier Reflux induzéiert ginn. D'PPIs si gutt toleréiert mat wéineg Nebenwirkungen. Nodeem dës Medikamenter gestoppt ginn, Symptomer vun Seier reflux normalerweis widderhuelen, heiansdo mat erhéicht Intensitéit. Dës Erhéijung vun de Symptomer geschitt deelweis wéinst enger Rebound Sekretioun vu Säure (Sauer Hypersekretioun), wat eng Äntwert ass, déi duerch d'Erhuelung vun der Inhibitioun vun der Sekretioun vu Säure duerch de PPI gefuerdert gëtt.
The long-term safety of the PPIs is an important consideration. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Dozou gehéieren:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Ass Hämorrhoidenchirurgie schmerzhaft?
Wat sinn Hämorrhoiden? Hämorrhoidektomie Chirurgie kann schmerzhaf sinn, awer verschidde Prozedure fir manner schlëmm Hämorrhoiden ze läschen kënne schmerzlos sinn. Hämorrhoiden, allgemeng als Pä
Ass Hämorrhoidenchirurgie schmerzhaft?
Wat sinn Hämorrhoiden? Hämorrhoidektomie Chirurgie kann schmerzhaf sinn, awer verschidde Prozedure fir manner schlëmm Hämorrhoiden ze läschen kënne schmerzlos sinn. Hämorrhoiden, allgemeng als Pä
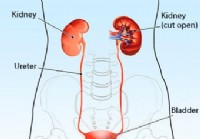 Niereninfektioun (Pyelonephritis)
Illustratioun vun den Nieren, Ureter, Blase an Urethra. Nier Infektioun Definitioun a Fakten Niereninfektioun ass eng vun enger Zuel vun Infektiounen, déi den Harnweeër involvéiere kënnen. Infektioun
Niereninfektioun (Pyelonephritis)
Illustratioun vun den Nieren, Ureter, Blase an Urethra. Nier Infektioun Definitioun a Fakten Niereninfektioun ass eng vun enger Zuel vun Infektiounen, déi den Harnweeër involvéiere kënnen. Infektioun
 Däi SIBO Geschäft Schaf stockéieren - Deel 2
Also wéi geet et mat Ärem SIBO Geschäft Schaf? Hutt Dir Är Iessschränke ‘Fréijoer gebotzt’ oder ‘Hierscht organiséiert’ a vun alen, verlockende Saachen, Saachen, déi Dir net am Schaf sollt hunn, lassg
Däi SIBO Geschäft Schaf stockéieren - Deel 2
Also wéi geet et mat Ärem SIBO Geschäft Schaf? Hutt Dir Är Iessschränke ‘Fréijoer gebotzt’ oder ‘Hierscht organiséiert’ a vun alen, verlockende Saachen, Saachen, déi Dir net am Schaf sollt hunn, lassg