 10 % der Patienten mit GERD entwickeln einen Barrett-Ösophagus, einen Risikofaktor für Speiseröhrenkrebs.
10 % der Patienten mit GERD entwickeln einen Barrett-Ösophagus, einen Risikofaktor für Speiseröhrenkrebs.

Barrett-Ösophagus hat keine einzigartigen Symptome. Patienten mit Barrett-Krankheit haben die folgenden Symptome von GERD oder saurem Reflux:
Barrett-Ösophagus ist eine Komplikation der chronischen gastroösophagealen Refluxkrankheit (GERD), vor allem bei weißen Männern. GERD ist eine Krankheit, bei der saure Flüssigkeit aus dem Magen in die Speiseröhre (die Schluckröhre) zurückfließt. GERD verursacht am häufigsten Sodbrennen.
Es gibt zwei Voraussetzungen für die Diagnose des Barrett-Ösophagus. Die Anforderungen erfordern eine Endoskopie der Speiseröhre. Während der Endoskopie wird ein langer flexibler Schlauch mit einem Licht und einer Kamera an seiner Spitze (ein Endoskop) durch den Mund und nach unten in die Speiseröhre eingeführt, um die Schleimhaut der Speiseröhre zu betrachten und zu biopsieren (Gewebeproben davon). Die beiden Anforderungen sind:
Barrett-Ösophagus wird von der Library of Congress für die elektronische Suche in der Literatur offiziell als Barrett-Ösophagus codiert, aber Barrett-Ösophagus (mit dem Apostroph „s“) ist der allgemein verwendete Name. Der Zustand ist nach einem Chirurgen, Norman Barrett, benannt, der den Zustand beschrieb. Es stellt sich jedoch heraus, dass seine Interpretation der Ergebnisse nicht korrekt war. Im Jahr 1953 beschrieben die Ärzte Allison und Johnstone diesen Zustand tatsächlich so, wie wir ihn heute verstehen, nämlich dass Metaplasie auftrat. (Metaplasie, die weiter unten diskutiert wird, ist der Begriff, der verwendet wird, wenn ein erwachsenes Gewebe ein anderes ersetzt.) Trotzdem wurde der Zustand mit Barretts Namen verewigt.
Anfänglich wurde angenommen, dass der Barrett-Ösophagus aus Magengewebe bestand, das das übliche Plattenepithel ersetzt, das den Ösophagus auskleidet. Mitte der 70er Jahre veröffentlichten Dr. Paull und Kollegen jedoch eine Arbeit, in der sie die Schleimhaut (innere Auskleidung) des Barrett-Ösophagus detaillierter als zuvor beschrieben. Sie wiesen darauf hin, dass Barrett-Ösophagus aus einer Metaplasie bestand, bei der die normalen Zellen, die die Speiseröhre auskleiden, durch eine Mischung aus Magen- und Darmauskleidungszellen ersetzt wurden. Die Auskleidungszellen vom Darmtyp werden auch als spezialisierte Säulenzellen bezeichnet, zu denen Becherzellen gehören. Einige Jahre lang dachten einige Wissenschaftler, dass es zwei Arten von Barrett gibt; eine, bei der die normale Auskleidung nur durch Zellen des Magentyps ersetzt wurde, und die zweite, bei der Darmzellen vorhanden waren. Derzeit wird jedoch angenommen, dass nur das Vorhandensein von Becherzellen vom Darmtyp die Diagnose des Barrett-Ösophagus begründet, unabhängig davon, welche anderen Zelltypen vorhanden sind.
Der Grund für das große Interesse am Barrett-Ösophagus liegt darin, dass er mit einem erhöhten Risiko für Speiseröhrenkrebs einhergeht. Die Art von Krebs, die bei Patienten mit Barrett-Krankheit auftritt, ist das Adenokarzinom, das aus dem metaplastischen Darmgewebe entsteht. Der übliche Krebs der Speiseröhre, der nicht mit Barrett-Krankheit in Verbindung gebracht wird, ist das Plattenepithelkarzinom, das aus der Plattenepithel-Auskleidung entsteht, die normalerweise in der Speiseröhre vorhanden ist. Der Zusammenhang zwischen Adenokarzinom des Ösophagus und Barrett-Ösophagus ist nun klar, und Adenokarzinom des Ösophagus nimmt in den meisten Ländern der westlichen Hemisphäre an Häufigkeit zu.
Die gute Nachricht ist jedoch, dass der Krebs bei relativ wenigen Patienten mit Barrett-Ösophagus auftritt. Die größte Herausforderung bei dieser Erkrankung besteht jedoch darin, auf Frühwarnzeichen für Krebs zu achten, indem während der Endoskopie in regelmäßigen Abständen Biopsien entnommen werden. Diese Praxis wird Surveillance genannt und ähnelt im Prinzip der Surveillance bei Frauen auf Gebärmutterhalskrebs, bei der in regelmäßigen Abständen PAP-Abstriche genommen werden.
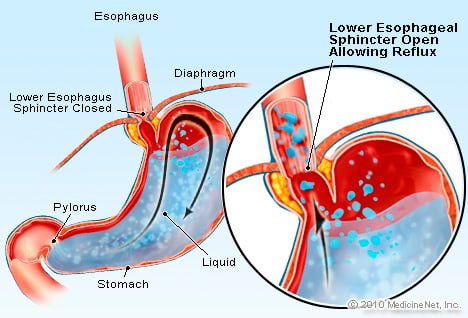
 GERD ist ein Zustand, bei dem übermäßig viel säurehaltige Flüssigkeit in die Speiseröhre zurückfließt, teilweise weil Der untere Ösophagussphinkter ist schwach.
GERD ist ein Zustand, bei dem übermäßig viel säurehaltige Flüssigkeit in die Speiseröhre zurückfließt, teilweise weil Der untere Ösophagussphinkter ist schwach. GERD verursacht Barrett-Ösophagus. Die Speiseröhre ist ein Muskelschlauch, der sich in der Brust befindet und dazu dient, Nahrung vom Mund in den Magen zu transportieren. Der untere Ösophagussphinkter (LES) ist eine Klappe, die sich an der Verbindung des Magens mit der Speiseröhre befindet. Seine Funktion besteht darin, zu verhindern, dass Säure und andere Mageninhalte zurück in die Speiseröhre gelangen. GERD ist ein Zustand, bei dem übermäßig viel säurehaltige Flüssigkeit in die Speiseröhre zurückfließt (fließt), teilweise weil der untere Ösophagussphinkter schwach ist. Die Schwäche des UÖS kann teilweise mit der Tatsache zusammenhängen, dass praktisch alle GERD-Patienten eine Hiatushernie haben. Bei Patienten mit Hiatushernie gleiten die oberen Zentimeter des Magens zwischen Bauch und Brust durch das Zwerchfell hin und her. Dieses Gleiten kann die Funktion des Schließmuskels als Barriere gegen den Rückfluss vom Magen in die Speiseröhre beeinträchtigen.
Früher wurde der Begriff Hernie anstelle von GERD verwendet, um Patienten die Grundlage ihrer Symptome (normalerweise Sodbrennen) zu erklären, da praktisch alle GERD-Patienten Hiatushernien haben. GERD ist jedoch der genauere Begriff. Während Hiatushernien in der Bevölkerung sehr häufig sind, entwickelt nur eine kleine Anzahl von Menschen mit Hiatushernie GERD. Mit anderen Worten, das Vorhandensein einer Hiatushernie bedeutet nicht, dass die Person GERD entwickeln wird. Auf der anderen Seite ist jedoch fast immer eine Hiatushernie vorhanden, wenn eine Person GERD hat.
So wird Barrett-Ösophagus durch chronischen (über viele Jahre andauernden) und meist schweren sauren Reflux verursacht. Bei manchen Patienten mit GERD reagiert die Speiseröhre auf die wiederholte Verletzung durch die saure Flüssigkeit, indem sie die Art der sie auskleidenden Zellen von Plattenepithel (normale Zellen) zu säulenförmigen (intestinale Zellen) ändert. Es wird angenommen, dass diese Metaplasie genannte Transformation eine Schutzreaktion ist, da das spezialisierte Säulenepithel (Epithel bedeutet Auskleidung) im Barrett-Ösophagus widerstandsfähiger gegen Säureverletzungen ist als das Plattenepithel.
Die Flüssigkeit im Magen enthält Säure, die vom Magen produziert wird. Darüber hinaus kann die Flüssigkeit jedoch Gallensäuren (aus der von der Leber produzierten Galle) und Enzyme (aus der Bauchspeicheldrüse produziert) enthalten, die aus dem Zwölffingerdarm in den Magen zurückgeflossen sind. (Der Zwölffingerdarm ist der erste Teil des Dünndarms direkt hinter dem Magen.) Die Säure, die aus dem Magen in die Speiseröhre zurückfließt, ist schädlich für die Speiseröhre. Es gibt jedoch Hinweise darauf, dass die Gallen- und Bauchspeicheldrüsenenzyme in Kombination mit der Säure schädlicher sein können als Säure allein.
Ein erheblicher Prozentsatz der Personen mit chronischen GERD-Symptomen entwickelt einen Barrett-Ösophagus, und er tritt am häufigsten in der kaukasischen männlichen Bevölkerung auf. Nicht jeder mit GERD hat jedoch Symptome von GERD. Daher wissen einige Menschen mit Barrett-Krankheit nicht, dass sie Barrett-Krankheit haben, weil sie GERD ohne jegliche Symptome haben oder sehr leichte und seltene Symptome haben.
Es ist unklar, warum Barrett-Ösophagus bei weißen Männern so überwältigend häufiger vorkommt als bei jeder anderen Gruppe. Obwohl Frauen und Afroamerikaner beispielsweise nicht vor der Entwicklung von GERD geschützt zu sein scheinen, sind sie (insbesondere Afroamerikaner) weitgehend vor der Entwicklung von Barrett-Ösophagus und Barrett-Krebs (Adenokarzinom) geschützt. Es gibt Hinweise darauf, dass in der westlichen Hemisphäre Speiseröhrenkrebs und Krebs des gastroösophagealen Übergangs (Kardiakrebs genannt) an Häufigkeit zunehmen, vielleicht mehr als jeder andere Magen-Darm-Krebs. (Allerdings ist Dickdarmkrebs immer noch sehr viel häufiger als Speiseröhrenkrebs.)
Barrett-Ösophagus kann in einigen Familien auftreten und genetisch bedingt sein. Derzeit werden Studien durchgeführt, um festzustellen, ob in diesen Familien Gene oder Marker gefunden werden können, die die Entwicklung des Barrett-Ösophagus in der Allgemeinbevölkerung vorhersagen würden. In diesen Familien mit Barrett-Krankheit sowie mit Barrett-Krankheit in der Allgemeinbevölkerung ist GERD der gemeinsame Nenner. Es stellt sich jedoch die Frage, warum das Barrett-Syndrom in diesen Familien häufiger auftritt als in anderen mit vergleichbar schwerer GERD, aber ohne familiären Zusammenhang.
Um es noch einmal zu wiederholen, das erste Kriterium für die Diagnose eines Barrett-Ösophagus ist der Befund bei der Endoskopie einer rosa Auskleidung in der Speiseröhre, wo sie normalerweise nicht zu sehen ist. Diese abnorme Auskleidung kann umlaufend wie ein Band, zungenartig oder als Inseln erscheinen. Das zweite Kriterium ist, dass Biopsien aus der rosa Auskleidung die charakteristische Darmschleimhaut (die normalerweise im Darm zu sehende Auskleidung) mit den typischen Becherzellen zeigen. Die Ösophagusbiopsien werden während einer Endoskopie gewonnen. Eine obere Magen-Darm-Endoskopie ist ein Verfahren, bei dem der Arzt einen langen flexiblen Schlauch (Endoskop) durch den Mund und hinunter in die Speiseröhre einführt, um die Auskleidung der Speiseröhre direkt sichtbar zu machen. Bei derselben endoskopischen Untersuchung können auch Magen und Zwölffingerdarm dargestellt werden. Durch das Endoskop können mehrere kleine Proben (Biopsien) des auskleidenden Epithelgewebes entnommen werden.
Wie bereits erwähnt, wird der Prozess des Ersatzes einer Art von Gewebeauskleidung durch eine andere als Metaplasie bezeichnet. Im Magen und Darm ist Metaplasie eine häufige Reaktion auf bestimmte Arten von Verletzungen. Wie Henry Appelman, ein Pathologe, sagte:„Wenn der Darm unter Stress steht, will er etwas anderes sein.“ Andere Beispiele für Metaplasie, bei der eine Auskleidung eine andere ersetzt, sind:(1) im Magen, wo eine chronische Entzündung (Gastritis) dazu führen kann, dass eine intestinale Auskleidung Teile der normalen Magenauskleidung ersetzt; und (2) im Zwölffingerdarm (direkt hinter dem Magen im Darm), wo peptische Geschwüre auftreten und die Darmschleimhaut, die das Geschwür umgibt, sich in eine Magenschleimhaut umwandelt.
Wir glauben, dass der Prozess der Metaplasie eine schützende oder adaptive Reaktion auf eine Verletzung der Auskleidung ist. Die Kehrseite der Metaplasie ist jedoch, dass sie im Barrett-Ösophagus ein kleines, aber deutlich erhöhtes Risiko hat, an Krebs zu erkranken. Nicht alle Metaplasien haben ein erhöhtes Krebsrisiko. Beispielsweise kann von den beiden im vorherigen Absatz erwähnten Metaplasien die Darmmetaplasie im Magen zu Krebs führen, die Darmmetaplasie im Zwölffingerdarm jedoch nicht.
Der Entstehungsprozess des Barrett-Syndroms beginnt am Übergang von Magen und Speiseröhrenschleimhaut. Die Speiseröhre ist normalerweise von einem Plattenepithel oder einer Auskleidungsschicht ausgekleidet. Dieses Plattenepithel hat ein perlweißes Aussehen, während die Auskleidung in Magen und Darm eine lachsrosa Farbe hat, da es sich eher um ein Säulenepithel als um ein Plattenepithel handelt. Das Plattenepithel besteht aus flachen Plattenepithelzellen, die Hautzellen ähneln. Unter dem Mikroskop gesehen besteht der Magen oder die Magenschleimhaut aus größeren Säulenzellen. Die Verbindung des Plattenepithels der Speiseröhre und des Magensäulenepithels tritt an der Verbindung von Speiseröhre und Magen auf, wo sich, wie Sie sich erinnern, der untere Ösophagussphinkter befindet. Die gemeinsame Grenze (Grenzfläche) dieser beiden Auskleidungen wird oft als Z-Linie bezeichnet, weil sie bei einer Endoskopie ein Zickzack-Aussehen hat.
Bei fortschreitender Verletzung der Speiseröhre tritt eine Metaplasie auf und das metaplastische Gewebe bewegt sich die Speiseröhre um eine Strecke nach oben, die von Person zu Person variiert, üblicherweise von etwa 0,5 bis 2,5 Zoll (etwa 1 bis 6 Zentimeter). Der Zelltyp, aus dem das metaplastische Gewebe entsteht, ist nicht bekannt.
Barrett-Ösophagus wird oft in kurz- oder langsegmentige Barrett-Ösophagus unterteilt, basierend auf der Länge der betroffenen Speiseröhre. Ein kurzes Segment Barrett bezieht sich im Allgemeinen auf eine Beteiligung von 3 Zentimetern oder weniger, während ein langes Segment eine Beteiligung von mehr als 3 Zentimetern der Speiseröhre bedeutet. Interessanterweise scheint die metaplastische Auskleidung nach der Diagnose eines Barrett-Ösophagus bei einem Patienten nicht weiter in die Speiseröhre vorzudringen, wenn der Patient wegen GERD behandelt wird. Daher bleibt die Dauer der Zusammenarbeit mit Barrett im Laufe der Zeit im Allgemeinen gleich.
Wenn Biopsien von Patienten mit GERD entnommen werden, die eine normal erscheinende Z-Linie haben (kein sichtbarer Hinweis auf einen Barrett-Ösophagus), zeigen bis zu 30 % dieselbe Metaplasie vom Darmtyp mit Becherzellen wie diejenigen, die im Barrett-Ösophagus zu sehen sind. Wir biopsieren jedoch nicht routinemäßig normal erscheinende Z-Linien, um nach dieser Veränderung zu suchen, noch führen wir eine Überwachung durch, wenn wir sie dort finden. Der Grund dafür ist, dass eine begrenzte intestinale Metaplasie der gastroösophagealen Übergangsregion bei GERD bei Frauen und Afroamerikanern mit ähnlicher Häufigkeit aufzutreten scheint wie bei weißen Männern, das Risiko eines offenen Barrett-Ösophagus jedoch viel geringer ist als bei weißen Männern.
Daher sollte das Vorhandensein einer Metaplasie bei einer Routinebiopsie einer normal erscheinenden Z-Linie bei GERD nicht zu einer Änderung der Behandlung führen. Darüber hinaus sollte der Fund von Becherzellen in diesem Zusammenhang nicht als Barrett-Syndrom mit ultrakurzen Segmenten bezeichnet werden, wie einige vorgeschlagen haben. Der Hauptgrund für die Nichtkennzeichnung als Barrett-Krankheit ist, dass der Begriff Barrett-Krankheit ein erhöhtes Krebsrisiko impliziert und es keine Hinweise darauf gibt, dass dieser Befund mit einem erhöhten Krebsrisiko verbunden ist.
Die Krebsart, die bei Barrett-Ösophagus auftritt, ist das Adenokarzinom. Krebs, der aus der Plattenepithelauskleidung der Speiseröhre entsteht, wird als Plattenepithelkarzinom oder Karzinom bezeichnet. Bei Kaukasiern nimmt die Rate (Häufigkeit im Laufe der Zeit) von Plattenepithelkarzinomen im Vergleich zum Barrett-assoziierten Adenokarzinom ab. Andere Rassengruppen (z. B. Afroamerikaner) haben jedoch nicht die gleiche Abnahmerate bei Plattenepithelkarzinomen im Vergleich zu Adenokarzinomen erfahren.
Rauchen und übermäßiger Alkoholkonsum sind eindeutige Risikofaktoren für Plattenepithelkarzinome. Sie sind auch Risikofaktoren für Adenokarzinome im Barrett-Ösophagus. In dieser Situation ist jedoch nicht klar, ob Rauchen und Alkohol das Risiko für ein Adenokarzinom erhöhen, indem sie GERD verschlimmern, oder ob Rauchen und Alkohol eine direktere krebserregende Wirkung haben, wie dies bei Plattenepithelkarzinomen der Fall ist. Plattenepithelkarzinome sind immer seltener geworden, während Adenokarzinom-Diagnosen gestiegen sind. Die Inzidenz von Adenokarzinomen bei weißen Männern ist stärker gestiegen als bei anderen ethnischen Gruppen.
Im weiteren Verlauf dieses Abschnitts bezieht sich der Begriff Speiseröhrenkrebs auf ein Adenokarzinom, das aus dem Barrett-Ösophagus entsteht.
Krebs des gastroösophagealen Übergangs wird auch als Kardiakrebs bezeichnet, da die Region, in der die Speiseröhre auf den Magen trifft, als Kardia bezeichnet wird. Dieser Krebs wird, wie das Barrett-assoziierte Adenokarzinom, überwiegend bei weißen Männern gefunden, nimmt offenbar mit der gleichen Rate wie Speiseröhrenkrebs an Häufigkeit zu und ist mit chronischem GERD verbunden. Daher wurde spekuliert, dass Kardiakrebs von kurzen Segmenten (z. B. 1–2 cm) des Barrett-Syndroms ausgeht. Bis die Krebsdiagnose gestellt wird, hat sich der Tumor jedoch möglicherweise über das kurze Segment des Barrett-Syndroms hinaus ausgebreitet und scheint sich in der Kardia zu befinden. Diese Spekulation über den Ursprung von Kardiakrebs muss jedoch noch bewiesen werden.
Eine Zunahme der Häufigkeit von Adenokarzinomen des Ösophagus wird seit mindestens 20 Jahren beobachtet, hauptsächlich bei weißen Männern. Ein Hinweis auf den Grund für diesen Trend könnte mit einer Abnahme der Häufigkeit von H. pylori Infektion des Magens. Mit anderen Worten, Menschen mit Barrett-Krebs, einschließlich Kardiakrebs, scheinen niedrigere Raten von H. pylori Infektion als andere des gleichen Alters und Geschlechts in der gleichen Population.
H. pylori ist eine Bakterienart, die eine Hauptursache für Geschwüre ist. Es ist eine weltweit sehr häufige Infektion und verursacht bei der überwiegenden Mehrheit der Betroffenen keine Symptome. Einige Menschen mit H. pylori Magengeschwür und Zwölffingerdarm entwickeln. Diese Geschwüre werden behandelt, indem die Bakterien eliminiert werden, was wiederum ein Wiederauftreten der Geschwüre verhindert.
Wenn H. pylori unbehandelt verursacht es eine fortschreitende Magenentzündung (Gastritis), die mit einer Verringerung der Säuresekretion und möglicherweise einem geringeren Rückfluss von Säure in die Speiseröhre einhergeht. In vielen Gebieten der Welt nimmt diese Infektion ab, vermutlich aufgrund besserer Maßnahmen im Bereich der öffentlichen Gesundheit. Daher ist es möglich, dass die Schutzwirkung (z. B. verringerte Säureproduktion) von chronischem H. pylori Die Infektion ist zurückgegangen. Mit anderen Worten, mit weniger H. pylori Gastritis, der Magen produziert mehr Säure und es fließt mehr Säure in die Speiseröhre zurück. Gleichzeitig sind wir in unseren älteren Jahren anfälliger für Reflux. Obwohl dies kein geklärtes Problem ist, ist die abnehmende Häufigkeit von H. pylori Infektion kann ein Grund für die zunehmende Häufigkeit von Barrett-assoziierten Adenokarzinomen sein.
Dysplasie ist eine Veränderung der Zellen, die die Speiseröhre auskleiden, wobei die Zellen tatsächlich abnormale Veränderungen in ihrer Struktur und ihrem Aussehen aufweisen. Wenn diese Veränderungen stark genug werden (von niedriggradiger zu hochgradiger Dysplasie), beginnen die Zellen bösartig zu erscheinen (wie Krebszellen). Im Gegensatz zu Krebs bleiben diese Zellen jedoch an Ort und Stelle und dringen nicht in Gewebe außerhalb der Auskleidung ein. Dysplasie tritt als eine Reihe von Zellveränderungen auf, wenn sich der Barrett-Ösophagus zu Barrett-assoziiertem Krebs entwickelt. Patienten mit Barrett-Krankheit werden mit Endoskopie und Biopsien (Überwachung) überwacht, um diese zellulären Veränderungen (die Dysplasie) oder im schlimmsten Fall Krebs im Frühstadium zu erkennen, damit sie behandelt werden können. Derzeit gibt es keine Möglichkeit vorherzusagen, welche Patienten mit Barrett-Ösophagus eine Dysplasie entwickeln werden.
Dysplasie wurde auch in der Nähe von anderen Tumoren des Gastrointestinaltrakts als Ösophagus-Adenokarzinom identifiziert. Dysplasie findet sich beispielsweise bei der Hälfte der Fälle von Magenkrebs und bei Dickdarmkrebs, bei denen die Dysplasie als sogenannte adenomatöse Polypen sichtbar ist. Darüber hinaus ist Dysplasie die gleiche Frühwarnzellveränderung, nach der Pathologen in PAP-Abstrichen des Gebärmutterhalses suchen, die Gebärmutterhalskrebs vorhersagen.
Dysplasie gilt als prämaligne. Das bedeutet, dass bei mehrfach nachgewiesener Dysplasie davon ausgegangen wird, dass der Patient an Krebs erkranken wird, wenn er oder sie lange genug lebt. Dysplasie wird als hochgradig oder niedriggradig kategorisiert. Wenn eine hochgradige Dysplasie diagnostiziert wird, kann bereits Krebs vorhanden sein, und wenn nicht, ist das Risiko, früher an Krebs zu erkranken, größer als bei den geringeren Graden von Dysplasie.
Bei Folgebiopsien von Patienten mit Dysplasie wird der Zustand bei einigen Patienten möglicherweise nicht erneut festgestellt, während bei anderen eine Dysplasie mit niedrigem Grad gefunden wird. Dieses Fehlen oder Verringern der Dysplasie kann auf Faktoren zurückzuführen sein, wie z. B. Probenvariationen, die Entfernung winziger Dysplasieherde (Zellgruppen) bei der anfänglichen Biopsie oder eine tatsächliche biologische Umkehrung. Die genauen Gründe sind unbekannt.
Mithilfe molekularer Techniken können einige als Biomarker bezeichnete Veränderungen in Biopsieproben nachgewiesen werden, bevor sich eine Dysplasie entwickelt. Diese Veränderungen ähneln denen, die bei anderen Krebsarten beobachtet werden. Zu den Biomarkern zählen Veränderungen im DNA-Gehalt von Zellen, in den Genen und Chromosomen sowie in Wachstumsfaktoren. Es kann gezeigt werden, dass eine Reihe dieser Biomarker vor und während des Auftretens einer Dysplasie auftreten. Das ultimative Ziel ist es, einen magischen Marker zu finden, der uns sagen kann, welche Patienten unter denen ohne Dysplasie oder niedriggradiger Dysplasie mit größerer Wahrscheinlichkeit hochgradige Dysplasie oder Krebs entwickeln. Solche Patienten können dann genauer überwacht werden als andere.
Derzeit werden alle Patienten mit Barrett-Ösophagus aus Sicht der Überwachung auf die gleiche Weise behandelt. Die Verfügbarkeit von Biomarkern würde Barrett-Patienten basierend auf ihrem Krebsrisiko trennen (stratifizieren). Eine solche Stratifizierung würde es Ärzten ermöglichen, Überwachungsendoskopien und Biopsien häufiger bei einer Minderheit von Patienten durchzuführen, die ein höheres Krebsrisiko haben, und weniger häufig bei Patienten, bei denen ein geringeres Krebsrisiko vorhergesagt wird.
Eine weitere Verwendung für bewährte Biomarker wäre die Bestätigung der Interpretation der Dysplasie durch den Pathologen bei Biopsien.
Wenn Patienten mit Barrett-Ösophagus als Gruppe beurteilt werden, wurde festgestellt, dass das Krebsrisiko bei nur einem von 300 Patienten jährlich liegt. Das heißt, wenn wir jährlich 300 Patienten untersuchen, würde jedes Jahr bei einem Patienten Krebs festgestellt werden. Was wir wirklich wissen müssen, ist das Krebsrisiko, wenn nach ein oder zwei Jahren Überwachung keine Dysplasie gefunden wird. Wir glauben, dass dieses Risiko viel geringer wäre als die zuvor zitierten Zahlen von einem von 300 Patienten pro Jahr.
Bei Patienten mit hochgradiger Dysplasie kann häufig Krebs festgestellt werden. Daher besteht die erste Behandlungsreihenfolge bei der Feststellung einer hochgradigen Dysplasie darin, das Vorhandensein eines Adenokarzinoms auszuschließen.
Niedriggradige Dysplasie ist viel weniger bedrohlich als hochgradige Dysplasie, aber wir wissen nicht, wie viel weniger. Tatsächlich haben wir keine genauen Daten, um genau das Krebsrisiko bei Patienten mit Barrett-Krankheit und niedriggradiger Dysplasie anzugeben.
Die Diagnose einer Dysplasie sollte so präzise wie möglich sein, da diese Diagnose eine Änderung der Behandlung oder der Intensität der Nachsorge von Patienten mit Barrett-Ösophagus veranlassen kann. Es erfordert viel Erfahrung, um das Vorhandensein und den Grad der Dysplasie genau diagnostizieren zu können. Daher ist es eine übliche und nützliche Praxis, einen zweiten Pathologen (oder sogar einen dritten, falls erforderlich) mit der Überprüfung der Biopsien zu beauftragen. Die Idee ist, zu sehen, ob es eine Einigung zwischen den Pathologen gibt und/oder eine erfahrenere Meinung über das Vorhandensein und den Grad der Dysplasie einzuholen.
Wenn eine Person ein Barrett-Segment mit einem längeren Segment hat, würde man vermuten, dass das Krebsrisiko größer ist als bei einem Barrett-Segment mit einem kürzeren Segment. Die Datenlage ist diesbezüglich jedoch umstritten. Aus diesem Grund besteht die derzeitige Praxis darin, bei Patienten mit Kurz- und Langsegment-Barrett-Ösophagus mit ähnlicher Häufigkeit eine endoskopische Biopsieüberwachung durchzuführen.
Barrett-Ösophagus hat keine einzigartigen Symptome. Patienten mit Barrett-Krankheit haben die Symptome von GERD (z. B. Sodbrennen, Aufstoßen, Übelkeit usw.). Der allgemeine Trend geht dahin, dass Barrett-Patienten eine schwerere GERD haben. Allerdings weisen nicht alle Barrett-Patienten deutliche GERD-Symptome auf, und einige Patienten werden versehentlich mit minimalen oder keinen GERD-Symptomen entdeckt.
Sodbrennen ist ein brennendes Gefühl hinter dem Brustbein, normalerweise in der unteren Hälfte, kann sich aber bis zum Hals erstrecken. Manchmal wird es von Brennen oder Schmerzen in der Magengrube direkt unterhalb des Endes des Brustbeins begleitet. Das zweithäufigste Symptom ist das Aufstoßen (Rückstau) von bitter schmeckender Flüssigkeit. GERD-Symptome sind oft schlimmer nach den Mahlzeiten und wenn sie flach liegen.
Die zurückgeflossene, hochgewürgte Flüssigkeit kann gelegentlich in die Lunge oder den Kehlkopf (Larynx) gelangen, was zu sogenannten extraösophagealen (außerhalb der Speiseröhre) Symptomen (Manifestationen) von GERD führt. Zu diesen Symptomen gehören:
Aus nicht vollständig verstandenen Gründen haben einige GERD-Patienten nur minimales Sodbrennen, leiden aber unter anderen GERD-Symptomen, zum Beispiel extraösophagealen Symptomen.
GERD kann zu Strikturen und Ulzerationen der Speiseröhre führen. Eine Striktur oder Verengung ist auf eine Vernarbung (Fibrose) der Speiseröhre zurückzuführen, die Schluckbeschwerden (Dysphagie) verursachen kann. Die Dysphagie wird als Anhaften (Stoppen) von fester Nahrung in der Brust (in der Speiseröhre) und von Flüssigkeiten wahrgenommen, wenn die Verengung stark ist. Strikturen können behandelt werden, indem sie während der Endoskopie mit Dilatatoren gedehnt werden. Unbehandelt können Strikturen ein vermehrtes Auslaufen von Nahrung und/oder Magensaft in die Lunge fördern. Gelegentlich können massive gastrointestinale (GI) Blutungen auftreten, die durch eine Entzündung der Speiseröhre verursacht werden. Solche Blutungen führen zum Erbrechen von Blut oder zum Abgang von schwarzem oder kastanienbraunem Stuhl. Häufiger jedoch kann eine entzündete Speiseröhre langsame Blutungen verursachen, die erkannt werden, wenn eine Anämie (eine niedrige Anzahl roter Blutkörperchen) festgestellt und/oder der Stuhl auf Blut untersucht wird.
Die medizinischen Behandlungen für die Symptome des Barrett-Ösophagus sind die gleichen wie bei GERD.
Die Säureunterdrückung ist das Rückgrat der Behandlung von GERD. Bei leichten Refluxsymptomen werden häufig rezeptfreie Medikamente eingesetzt, die von Antazida bis hin zu niedrig dosierten Medikamenten, sogenannten H-2-Rezeptorantagonisten oder H2-Blockern, reichen. Beispiele für rezeptfreie H2-Blocker sind Cimetidin (Tagamet) und Famotidin (Pepcid, Zantac 360). Bei anhaltenderen Symptomen können höhere (verschreibungspflichtige) Dosen der H-2-Rezeptor-Antagonisten verwendet werden, zum Beispiel:
Bei anhaltenden Symptomen, die eine (fortlaufende) Erhaltungstherapie erfordern, oder bei komplizierter GERD mit Strikturen oder Blutungen werden jedoch Protonenpumpenhemmer (PPI) eingesetzt. Beispiele für PPIs sind:
Einige Patienten müssen nur eine Tablette täglich einnehmen, während andere zwei Tabletten (eine doppelte Dosis) benötigen, um die Symptome zu kontrollieren. Die doppelte Dosis kann als eine Tablette zweimal täglich oder 2 Tabletten einmal täglich eingenommen werden.
PPIs sind starke Inhibitoren der Säuresekretion aus dem Magen. Sie sind wirksam bei der Linderung von Sodbrennen und der Heilung von Speiseröhrenentzündungen (Ösophagitis) und Speiseröhrengeschwüren, die durch sauren Rückfluss verursacht werden. Die PPIs sind gut verträglich mit wenigen Nebenwirkungen. Nach dem Absetzen dieser Medikamente treten die Symptome des sauren Refluxes normalerweise wieder auf, manchmal mit erhöhter Intensität. Diese Zunahme der Symptome tritt zum Teil aufgrund einer Rebound-Sekretion von Säure (Säure-Hypersekretion) auf, die eine Reaktion ist, die durch die Erholung von der Hemmung der Säuresekretion durch den PPI ausgelöst wird.
Die langfristige Sicherheit der PPIs ist ein wichtiger Gesichtspunkt. Obwohl in Experimenten mit älteren weiblichen Ratten über bestimmte Magentumore (Karzinoide) berichtet wurde, wurden ähnliche Tumore bei Menschen nach mehr als 15 Jahren PPI-Einnahme nicht beobachtet. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Dazu gehören:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Metformin könnte einem undichten Darm helfen
Metformin könnte einem undichten Darm helfen
 Gesundheitstipp:Behalten Sie Morbus Crohn unter Kontrolle
Gesundheitstipp:Behalten Sie Morbus Crohn unter Kontrolle
 Diagnose der akuten mesenterialen Lymphadenitis - Diagnose des akuten Abdomens
Diagnose der akuten mesenterialen Lymphadenitis - Diagnose des akuten Abdomens
 Kann Prilosec Magenkrebs verursachen?
Kann Prilosec Magenkrebs verursachen?
 Sind stechende Bauchschmerzen während der Schwangerschaft normal?
Sind stechende Bauchschmerzen während der Schwangerschaft normal?
 Was löst Divertikulitis-Schübe aus?
Was löst Divertikulitis-Schübe aus?
 Marburg-Virus-Krankheit
Fakten, die Sie über die Marburg-Virus-Krankheit wissen sollten Bild:Eine Frau mit Marburg-Virus-Infektion hat einen Ausschlag auf dem Rücken; QUELLE:CDC Die Marburg-Virus-Krankheit ist in Afrika end
Marburg-Virus-Krankheit
Fakten, die Sie über die Marburg-Virus-Krankheit wissen sollten Bild:Eine Frau mit Marburg-Virus-Infektion hat einen Ausschlag auf dem Rücken; QUELLE:CDC Die Marburg-Virus-Krankheit ist in Afrika end
 Der Verlust des Mikrobioms durch den Einsatz von Antibiotika beeinflusst die Reaktion auf den Grippeimpfstoff
Jeder lebende Mensch hat Billionen von Mikroben, die in seinem Verdauungstrakt leben. und mehr als 400 Bakterienarten im Darm, mehr als die Anzahl der Zellen im Körper. Die normale Darmflora ist wicht
Der Verlust des Mikrobioms durch den Einsatz von Antibiotika beeinflusst die Reaktion auf den Grippeimpfstoff
Jeder lebende Mensch hat Billionen von Mikroben, die in seinem Verdauungstrakt leben. und mehr als 400 Bakterienarten im Darm, mehr als die Anzahl der Zellen im Körper. Die normale Darmflora ist wicht
 Bestimmte Bakterienarten können das HIV-Risiko bei Frauen erhöhen,
findet neue Studie Eine kürzlich in der veröffentlichte Studie Die Lancet-Infektionskrankheiten, beschreibt sieben Arten von Vaginalbakterien, die das Risiko einer HIV-Infektion bei Frauen signifik
Bestimmte Bakterienarten können das HIV-Risiko bei Frauen erhöhen,
findet neue Studie Eine kürzlich in der veröffentlichte Studie Die Lancet-Infektionskrankheiten, beschreibt sieben Arten von Vaginalbakterien, die das Risiko einer HIV-Infektion bei Frauen signifik