 Новый коронавирус SARS-CoV-2 Цветная сканирующая электронная микрофотография апоптотической клетки (зеленый), сильно инфицированной частицами вируса SARS-COV-2 (оранжевый), выделен из образца пациента. Изображение в Комплексном исследовательском центре НИАИД (IRF) в Форт-Детрике, Мэриленд. Предоставлено:NIAID.
Новый коронавирус SARS-CoV-2 Цветная сканирующая электронная микрофотография апоптотической клетки (зеленый), сильно инфицированной частицами вируса SARS-COV-2 (оранжевый), выделен из образца пациента. Изображение в Комплексном исследовательском центре НИАИД (IRF) в Форт-Детрике, Мэриленд. Предоставлено:NIAID. SARS-CoV-2, возбудитель пандемии деструктивного коронавирусного заболевания (COVID-19), в первую очередь рассматривается как респираторный патоген; тем не мение, данные свидетельствуют о том, что вирус может независимо реплицироваться в кишечнике, повышение вероятности фекально-оральной передачи.
Это действительно может быть важной проблемой при трансплантации фекальной микробиоты, который представляет собой процесс переноса стула от здорового донора в кишечник пациента с целью восстановления микробиома кишечника. В настоящее время, этот подход рекомендуется при частых внутрибольничных инфекциях с Clostridioides difficile и в настоящее время исследуется как экспериментальный подход для многих других условий.
Тем не мение, несмотря на консенсус о том, что доноры микробиоты плода должны проходить скрининг на SARS-CoV-2, оптимальная стратегия выявления бессимптомного носительства среди доноров все еще не определена, пока комбинация тестов еще не оценивалась и не сравнивалась.
Следовательно, исследователи из OpenBiome (т. е. некоммерческая организация в Массачусетсе, которая управляет общественным банком стула и поддерживает исследования, разработанные в области человеческого микробиома) разработала математическую модель инфекции SARS-CoV-2 среди доноров фекальных трансплантатов, которая имитирует эффект различных стратегий тестирования.
Суммируя, эти ученые построили абстрактную модель доноров фекальной микробиоты для трансплантации, моделирование их графика пожертвований, заболеваемость SARS-CoV-2, а также течение заболевания COVID-19.
Поверх этих имитаций были применены различные стратегии скрининга - с учетом субоптимальной чувствительности и специфичности каждого теста - для того, чтобы оценить, сколько вирус-отрицательных и вирус-положительных пожертвований будет надлежащим или нежелательным образом выпущено. соответственно.
Соответственно, разработанная модель представила два результата:количество «истинно отрицательных», "вирус-отрицательные пожертвования выпущены, и количество «ложноотрицательных», выпущены вирус-положительные пожертвования.
Как следствие, желательный подход к скринингу привел бы к выдаче большого количества вирус-отрицательных пожертвований и лишь небольшого количества или отсутствия вирус-положительных пожертвований; с другой стороны, плохая стратегия приведет к ненужному уничтожению большого количества вирус-отрицательных пожертвований или высвобождению множества вирус-положительных пожертвований.
"Модель количественно оценивает влияние более строгих испытаний на желаемое снижение потенциально инфекционных, вирус-положительные пожертвования, переработанные в материал для трансплантации фекальной микробиоты и выпущенные для использования, а также нежелательное сокращение количества выпущенных вирус-отрицательных пожертвований ", Авторы исследования обобщают свой методологический подход.
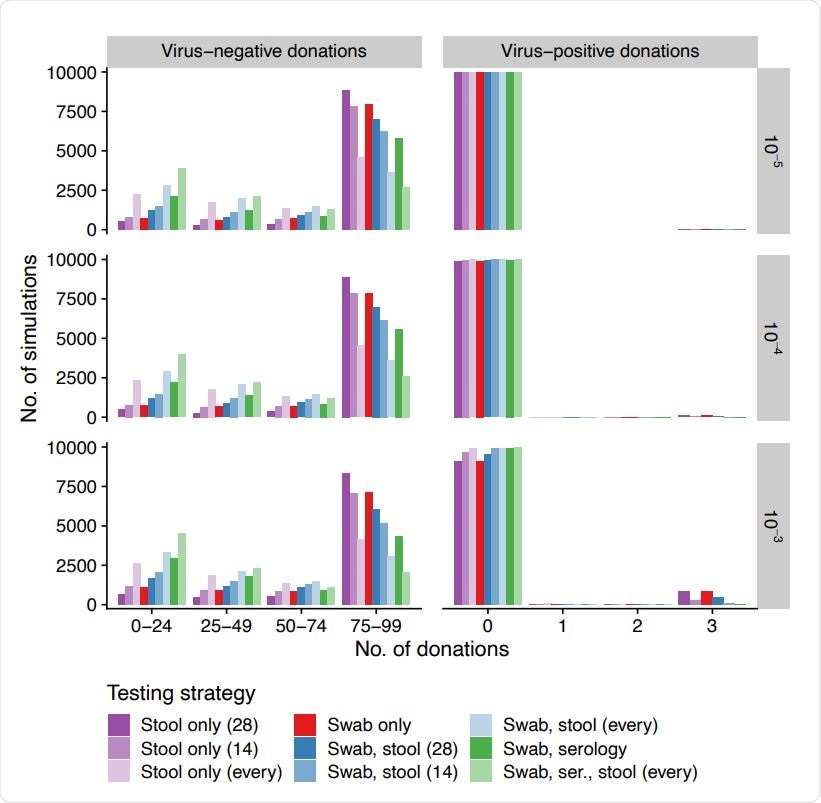 Количество отправленных вирус-отрицательных и -положительных пожертвований (столбцы, ось абсцисс) по моделированию (ось ординат) для различных ежедневных заболеваемости (строки, инфекций на человека в день) при использовании разных стратегий тестирования (цветов). Мазки всегда берутся с 14-дневным интервалом, а серология - с 60-дневным интервалом. Анализы стула проводятся с 14-дневным интервалом, 28-дневные интервалы, или за каждое пожертвование.
Количество отправленных вирус-отрицательных и -положительных пожертвований (столбцы, ось абсцисс) по моделированию (ось ординат) для различных ежедневных заболеваемости (строки, инфекций на человека в день) при использовании разных стратегий тестирования (цветов). Мазки всегда берутся с 14-дневным интервалом, а серология - с 60-дневным интервалом. Анализы стула проводятся с 14-дневным интервалом, 28-дневные интервалы, или за каждое пожертвование. Количество переданных пожертвований с положительным и отрицательным вирусом различается по результатам моделирования и зависит от стратегии тестирования и частоты инфицирования. Суммируя, самые чувствительные стратегии оказались и наименее конкретными.
"В основном, более чувствительные стратегии позволили получить меньше вирус-положительных пожертвований, но также забрали доноров раньше из-за ложноположительных результатов и, следовательно, выпустили меньше вирус-отрицательных пожертвований на одного донора, "далее уточнили авторы исследования.
Кроме того, разница в риске высвобожденного вирус-положительного материала при сравнении наиболее и наименее строгих стратегий была эквивалентна эффекту 100-кратного изменения ежедневной заболеваемости SARS-CoV-2.
Когда проводился анализ чувствительности, параметры, которые были тесно связаны с двумя упомянутыми выше исходами, - это интервал донорства (т. е. более длительный интервал дает меньшее количество вирус-отрицательных доноров), характеристики трех тестов (т. е. больше вирус-отрицательных пожертвований, выпущенных с использованием специальных тестов), и заболеваемость SARS-CoV-2 (т.е. более высокая заболеваемость коррелировала с увеличением количества жертвованных вирусов).
Сила этого анализа состоит в том, что он количественно решает животрепещущий клинический вопрос. Еще, все количественные прогнозы, сделанные с помощью модели, следует рассматривать как руководство к клиническим рассуждениям, а не как четкие и недвусмысленные прогнозы.
Более того, проверка этой модели может оказаться довольно сложной задачей, поскольку возможность фекально-оральной передачи SARS-CoV-2 не подтверждена, и не существует «золотого стандарта» для обнаружения этого вирусного агента в образцах стула. Также, многие допущения в модели могут больше не применяться.
"Хотя эти результаты обнадеживают, мы снова предупреждаем, что они зависят от ряда предположений относительно качества тестирования и эпидемиологии SARS-CoV-2, которые будут уточнены в ближайшие месяцы », говорят авторы исследования.
Тем не менее, этот метод действительно ценен для оценки рисков передачи в этой продолжающейся пандемии. Помимо, этот подход может быть использован в качестве шаблона для оценки стратегий тестирования других патогенных микроорганизмов или методов лечения, полученных от человека, помимо трансплантации фекальной микробиоты.
bioRxiv публикует предварительные научные отчеты, не прошедшие рецензирование, и, следовательно, не следует рассматривать как окончательный, руководить клинической практикой / поведением, связанным со здоровьем, или рассматриваться как установленная информация.
 Что древние фекалии могут рассказать нам об эволюции микробиома кишечника человека?
Что древние фекалии могут рассказать нам об эволюции микробиома кишечника человека?
 Perfectus Biomed примет участие в конференции IPS в Ливерпуле
Perfectus Biomed примет участие в конференции IPS в Ливерпуле
 Технология органных чипов улучшает исследование кишечника для персонализированной медицины
Технология органных чипов улучшает исследование кишечника для персонализированной медицины
 Молочнокислые бактерии и кишечные бактерии способствуют пользе ржи для здоровья,
Молочнокислые бактерии и кишечные бактерии способствуют пользе ржи для здоровья,
 Хронический кашель можно облегчить с помощью нового препарата
Хронический кашель можно облегчить с помощью нового препарата
 Исследования связывают распространенность SARS-CoV-2,
Исследования связывают распространенность SARS-CoV-2,
 Ингибиторы GSK-3 перспективны при лечении коронавирусных инфекций
Исследователи из США предложили новый подход к лечению инфекции коронавирусом, такой как коронавирус 2 (SARS-CoV-2), вызывающий коронавирусную болезнь 2019 (COVID-19), при тяжелом остром респираторном
Ингибиторы GSK-3 перспективны при лечении коронавирусных инфекций
Исследователи из США предложили новый подход к лечению инфекции коронавирусом, такой как коронавирус 2 (SARS-CoV-2), вызывающий коронавирусную болезнь 2019 (COVID-19), при тяжелом остром респираторном
 Ополаскиватель для рта влияет на эффект упражнений
Ученым давно известно, что кровяное давление падает после тренировки, но механизм этого до конца не выяснен. Новое исследование показывает, что бактерии во рту, которые производят нитриты, является кл
Ополаскиватель для рта влияет на эффект упражнений
Ученым давно известно, что кровяное давление падает после тренировки, но механизм этого до конца не выяснен. Новое исследование показывает, что бактерии во рту, которые производят нитриты, является кл
 Распространение супербактерии E. coli из-за плохой гигиены туалета,
не через еду Новое исследование опубликовано в Ланцетные инфекционные болезни 22 октября, 2019, говорит, что одна распространенная супербактерия вызывает более 5, 000 случаев пищевого отравления в А
Распространение супербактерии E. coli из-за плохой гигиены туалета,
не через еду Новое исследование опубликовано в Ланцетные инфекционные болезни 22 октября, 2019, говорит, что одна распространенная супербактерия вызывает более 5, 000 случаев пищевого отравления в А