Kreft er en sykdom som skyldes mutasjoner i genene til organismen som påvirkes av den. Disse mutasjonene resulterer i dysregulering av cellene som er involvert, slå av programmer som modulerer cellevekst og spredning, eller som danner svulster.
Derimot, all menneskelig kreft er ikke forårsaket av mutasjoner i det menneskelige genomet alene. For eksempel, kreft i bukspyttkjertelen er oftest vert for mikrober som bryter ned de mest brukte cellegiftmedisinene hos disse pasientene, som vist av en studie fra 2017 i tidsskriftet Science. Dette fikk forskeren Gregory Poore til å forfølge mikrobenes rolle i ulike kreftformer.
Samarbeid med eksperter på tvers av forskjellige disipliner, forskerne utforsket de flerlags interaksjoner som oppstår mellom svulster og mange mikrober som lever på og i menneskekroppen. Seniorforsker Rob Knight sa:"Nesten alle tidligere kreftforskningsinnsatser har antatt at svulster er sterile miljøer og ignorert det komplekse samspillet mellom menneskelige kreftceller kan ha med bakteriene, virus og andre mikrober som lever i og på kroppen vår. Antall mikrobielle gener i kroppene våre er langt større enn antallet menneskelige gener, så det burde ikke være overraskende at de gir oss viktige ledetråder til helsen vår. "
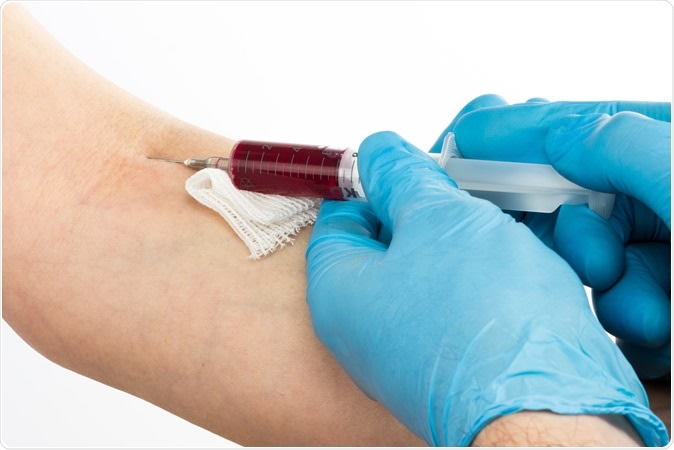 Det er målet for flere selskaper som for tiden utvikler 'flytende biopsier' for å oppdage sirkulerende menneskelig tumor -DNA ved å oppdage kreft i de tidligste stadiene ved en enkel blodtaking. Nå har UC San Diego -forskere vist at de kan avgjøre hvem som har kreft, og hvilken type, basert på en avlesning av mikrobielt DNA som finnes i blodet. Bildekreditt:Szabolcs Borbely / Shutterstock
Det er målet for flere selskaper som for tiden utvikler 'flytende biopsier' for å oppdage sirkulerende menneskelig tumor -DNA ved å oppdage kreft i de tidligste stadiene ved en enkel blodtaking. Nå har UC San Diego -forskere vist at de kan avgjøre hvem som har kreft, og hvilken type, basert på en avlesning av mikrobielt DNA som finnes i blodet. Bildekreditt:Szabolcs Borbely / Shutterstock Det første trinnet var å undersøke dataene om mikrobielle gener arkivert i The Cancer Genome Atlas, som er en massiv database med tumorassosierte genomiske data samlet inn fra tusenvis av svulster og vedlikeholdt av National Cancer Institute. Forskerne sier at deres er første gang forskere har forsøkt å identifisere mikrobielt DNA fra menneskelige genomiske data i en så imponerende skala.
De undersøkte over 18, 000 prøver av humane svulster, tatt fra nesten 10, 500 pasienter med 33 forskjellige typer svulster. De prøvde å finne særegne mønstre av mikrobielle gener assosiert med spesifikke svulster. Noen er allerede kjent, slik som koblingen mellom HPV (humant papillomavirus) og kreft i livmorhalsen, hode, og nakke, eller det av Fusobacterium arter med kreft i tarmen.
Forskerne tok også opp mange nye mikrobielle mønstre som var i stand til å skille en krefttype fra en annen. Ett eksempel er det Faecalibacterium , en art som kan plukke ut tykktarmskreft fra andre svulsttyper.
Forskerne kom dermed til en forståelse av hvordan mikrobiomet til tusenvis av kreftprøver ser ut. Det neste trinnet var å bruke kraften i maskinlæring for å se om noen av disse mikrobielle mønstrene var spesifikke for kreft av visse typer. De trente maskinlæringsprogrammene sine for å plukke opp slike spesifikke assosiasjoner og bruke dem til å diagnostisere krefttypen. De testet deretter sine hundrevis av modeller og fant, til deres tilfredsstillelse, at de kunne identifisere typen kreft-basert utelukkende på det mikrobielle DNA i blodet.
Det neste steget, for forskerne, skulle eliminere avanserte kreftformer fra datasettet. Programmet var fremdeles i stand til å skille mange typer kreft i trinn I og II bare basert på mikrobielle data. Forskerne utførte deretter strenge prosedyrer for å dekontaminere data fra bioinformatikk, noe som betyr at over 90% av mikrobielle data ble fjernet. Selv om, maskinen identifiserte riktig mange tidlige kreftformer etter type.
I en pilotstudie, forskerteamet tok blodprøver fra rundt 100 pasienter med tre typer kreft, inkludert omtrent 60, 25, og 15 pasienter, hver med prostata, lunge, og melanomkreft. De brukte sine skreddersydde verktøy for å sikre at dataene var så pålitelige som mulig ved å eliminere forurensende avlesninger. De tok deretter avlesninger av den mikrobielle profilen for hver av blodprøvene.
Sammenligning av disse profilene med hverandre og med plasmaprøver tatt fra rundt 70 sykdomsfrie frivillige, teamet fant ut at maskinlæringsmodellene deres kunne differensiere mennesker med kreft fra de uten det, i de fleste tilfeller. Det er, de kan hente 86% av mennesker med lungekreft mens de utelukker lungesykdom riktig hos alle individer som er negative for denne tilstanden. De kunne også skille mellom hver av kreftformene. For eksempel, de kunne med rette fortelle i 81% av tilfellene om pasienten hadde lungekreft eller prostatakreft.
Medforfatter Sandip Pravin Patel sier, "Evnen, i et enkelt blodrør, å ha en omfattende profil av svulstens DNA (natur) samt DNA fra pasientens mikrobiota (pleie), så å si, er et viktig skritt fremover for å bedre forstå vert-miljø-interaksjoner i kreft. "Han forklarer at det er mulig å bruke denne tilnærmingen for å holde styr på hvordan svulstens genom og mikrobiota endres med tiden, Dermed brukes den ikke bare som et diagnostisk, men som et overvåkingsverktøy for langsiktig oppfølging av behandlingens effekt.
Han fortsetter, "Dette kan ha store implikasjoner for omsorgen for kreftpasienter, og i tidlig påvisning av kreft hvis disse resultatene fortsetter å holde seg i ytterligere testing. "
Patel forklarer at de fleste kreftformer i dag bare kan diagnostiseres ved kirurgisk biopsi, som innebærer å fjerne et stykke av den mistenkte svulsten og få den undersøkt av eksperter. Diagnosen er basert på de molekylære markørene som er spesifikke for hver type kreft. Problemet med denne tilnærmingen er at den er invasiv, tar tid, og er dyrt.
Nylig, flytende biopsier er utviklet for mange av disse kreftformene. Her brukes en blodprøve for å oppdage spesifikke mutasjoner i humant DNA som finnes i sirkulasjon for å diagnostisere spesifikke svulster. Mens blodmarkører (for det meste molekyler som finnes på overflaten av tumorceller) allerede brukes til å diagnostisere og overvåke forløpet av noen svulster, genetiske markører er relativt nye. De brukes i noen svulster for å spore sykdomsforløpet, men deres bruk for tumordiagnose er ikke godkjent av Food and Drug Administration (FDA).
Årsaken er den dårlige nøyaktigheten til disse testene ved å skille mellom normale variasjoner i menneskelige gener og den sanne tilstedeværelsen av mutasjoner ved tidlig kreft. Ikke bare slik, sier Patel, "de kan ikke fange opp kreftformer der menneskelige genomiske endringer ikke er kjent eller ikke kan påvises."
Dette betyr at flytende biopsier sannsynligvis vil ha en høy grad av falske negativer, spesielt for sjeldne svulster. Hvis mutasjonshastigheten er lav, og antallet skurceller er også lavt, sjansene for å plukke opp mutasjonen er faktisk få. Og dermed, pasienten kan godt bli fortalt at det ikke er tegn på kreft til tross for tilstedeværelsen av en svulst.
Den nåværende testen som er basert på påvisning av mikrobielt DNA i stedet for tumor -DNA, er at det gjenspeiler mer merkbare endringer fordi, i motsetning til ensartethet av menneskelig DNA i alle vev i menneskekroppen, mikrobielle DNA -profiler varierer enormt fra vev til vev. Og dermed, i stedet for å håpe å plukke opp en av de relativt sjeldne endringene i menneskelig DNA for å diagnostisere en svulst, det er lettere å fange opp endringer i det mikrobielle DNA som nøyaktig kan gjenspeile tilstedeværelsen av kreft og deres type, tidligere i prosessen med tumordannelse, sammenlignet med flytende biopsier, i hvert fall på det nåværende stadiet. Dette er også sant om kreft som ikke har genetiske mutasjoner som for øyeblikket kan påvises ved bruk av flytende biopsier.
Den nåværende plattformen kan fortsatt returnere falske negativer, sier forskerne, men de foredler tilnærmingen med flere data for å øke nøyaktigheten av prediksjon. En annen fare med denne tilnærmingen er overdiagnostisering av svulster eller høy falsk positiv frekvens.
Og for det tredje, mange mutasjoner er ikke kreft, men er relatert til alder eller er av den typen som løser seg spontant. Faktisk, uten mikrobiell DNA -testing, individet ville aldri vite om dem i det hele tatt. Selv noen tidlige kreftformer fortjener egentlig ikke behandling. Som et resultat, Det er viktig å huske at screening og diagnostisering av kreft tidlig ikke alltid er nødvendig. Behovet for slike prosedyrer bør avgjøres av en kliniker.
Positive mikrobielle avlesninger bør heller ikke betraktes som kreft med mindre ytterligere tester er utført for å bekrefte at en svulst er tilstede, bestemme typen og plasseringen.
Teamet ser frem til å utvikle en FDA-godkjent test for å diagnostisere kreft.
For å oppnå dette, de trenger å profilere de 'normale' mikrobielle mønstrene blant friske mennesker i mange forskjellige populasjoner. For det andre, de må bestemme om de mikrobielle signaturene som finnes i dødt blod gjenspeiler tilstedeværelsen av døde, bo, eller åpne mikrober. Dette er viktig for å utvikle en mer nøyaktig tilnærming.
De foreløpige funnene må valideres i en større populasjon med et mye større antall pasienter, som innebærer en kostnad på forhånd. For å hjelpe til med å nå sine mål, teamet har sendt inn patentsøknader og startet et selskap som heter Micronoma.
Forskerne påpeker at selv om mikrobiologer vanligvis bruker dekontaminasjonsprotokoller i arbeidet sitt, det er ikke en vanlig praksis i kreftstudier. De håper denne studien vil endre vekt på kreftbiologi, ved å gjøre kreftforskere mer bevisste på mikrober i menneskekroppen.
For det andre, det kan bidra til å skyve det nye feltet av kreftassosierte blodmikrobiomer fremover til terapi, hjelpe til med å forstå hva mikrober gjør ved kreft og om de kan brukes til å behandle disse tilstandene. Og i så fall, det neste spørsmålet er om de kan tilføres eller etterlignes for å behandle kreft mer vellykket.
 Bruk FLUOstar Omega til å studere nye tarmbakterier som kan påvirke helsen vår
Bruk FLUOstar Omega til å studere nye tarmbakterier som kan påvirke helsen vår
 Allergi knyttet til høyere søppelmatforbruk,
Allergi knyttet til høyere søppelmatforbruk,
 Parkinsons sykdom kan forebygges av tarmmikrober
Parkinsons sykdom kan forebygges av tarmmikrober
 Pankreatitt
Pankreatitt
 Vanlig sopp som finnes på huden kan forårsake inflammatorisk tarmsykdom
Vanlig sopp som finnes på huden kan forårsake inflammatorisk tarmsykdom
 Migrasjon påvirker tarmmikrobiota som igjen påvirker helsefunnforskere
Migrasjon påvirker tarmmikrobiota som igjen påvirker helsefunnforskere
 Plantebaserte dietter forbedrer hjertehelsen via tarmmikrobiomet
En ny studie publisert i februar 2020 i Journal of American College of Cardiology rapporterer at et redusert inntak av animalsk mat og et kosthold basert på planter kan resultere i en lavere risiko
Plantebaserte dietter forbedrer hjertehelsen via tarmmikrobiomet
En ny studie publisert i februar 2020 i Journal of American College of Cardiology rapporterer at et redusert inntak av animalsk mat og et kosthold basert på planter kan resultere i en lavere risiko
 Kronisk hoste kan lindres med nytt stoff
Et par studier har vist at kronisk hoste og de plagsomme symptomene kan lindres ved hjelp av et nytt stoff. Også, stoffet har ingen bivirkninger som kan begrense bruken, forklarer forskerne. Resultate
Kronisk hoste kan lindres med nytt stoff
Et par studier har vist at kronisk hoste og de plagsomme symptomene kan lindres ved hjelp av et nytt stoff. Også, stoffet har ingen bivirkninger som kan begrense bruken, forklarer forskerne. Resultate
 Studie avslører antivirale effekter av curcumin
Curcumin, en naturlig forbindelse som finnes i kryddergurkemeien, kan bidra til å eliminere visse virus, forskning har funnet. En studie publisert i Journal of General Virology viste at curcumin k
Studie avslører antivirale effekter av curcumin
Curcumin, en naturlig forbindelse som finnes i kryddergurkemeien, kan bidra til å eliminere visse virus, forskning har funnet. En studie publisert i Journal of General Virology viste at curcumin k