Além das frequentemente comentadas mutações do gene BRCA, há um número significativo de outros mutações genéticas hereditárias que aumentam o risco de desenvolver câncer de mama. De fato, acredita-se que mutações em mais de 100 genes contribuam para o risco, e espera-se que o número de mutações genéticas não BRCA que aumentam o risco de câncer de mama cresça à medida que aumenta nosso conhecimento sobre a genética do câncer.
Além das mutações dos genes BRCA1 e BRCA2, algumas delas incluem mutações em ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 e muito mais. Vejamos a importância dessas mutações não-BRCA1/BRCA2 no câncer de mama familiar e algumas das características das mais comumente encontradas.
Acredita-se atualmente que 5% a 10% dos cânceres de mama são genéticos ou familiares ( embora esse número possa mudar à medida que aprendemos mais), mas nem todos esses cânceres são devidos a mutações BRCA.
No máximo, 29% (e provavelmente muito menos) cânceres de mama hereditários testam positivo para mutações nos genes BRCA1 ou BRCA2, e muitas pessoas estão buscando testes para outras alterações genéticas conhecidas.
Já que a ciência por trás do câncer hereditário provoca muita ansiedade, para não falar de confusão e incompleta, é útil começar falando sobre a biologia das mutações genéticas e como essas mudanças no DNA desempenham um papel no desenvolvimento do câncer.
Ao falar sobre mutações, é importante distinguir entre mutações genéticas herdadas e adquiridas.
Mutações genéticas adquiridas ou somáticas têm recebido muita atenção nos últimos anos, pois estas mutações causam mudanças que impulsionam o crescimento do câncer. As terapias direcionadas, medicamentos que visam vias específicas relacionadas a essas alterações, melhoraram significativamente o tratamento de alguns tipos de câncer, como o câncer de pulmão.
As mutações adquiridas, no entanto, não estão presentes desde o nascimento, mas são formadas a qualquer tempo após o nascimento no processo de uma célula se tornar uma célula cancerosa. Essas mutações afetam apenas algumas células do corpo. Eles não são herdados de um dos pais, mas sim "adquiridos" à medida que o DNA nas células é exposto a danos do ambiente ou como resultado dos processos metabólicos normais do corpo.
Mutações herdadas ou da linhagem germinativa, em contraste, são alterações genéticas que as pessoas são nascidos com, e que são transmitidos por um ou ambos os pais. Essas mutações afetam todas as células do corpo. São essas mutações hereditárias (e outras alterações genéticas) que podem aumentar a chance de uma pessoa desenvolver câncer e explicar o que é conhecido como câncer de mama hereditário ou familiar.
Mutações genéticas hereditárias (germinais) vs. adquiridas (somáticas)
Muitas pessoas se perguntam como exatamente um gene anormal ou combinações de genes podem levar ao câncer de mama , e uma breve discussão sobre a biologia é útil para entender muitas das questões, como por que nem todos que têm essas mutações desenvolvem câncer.
Nosso DNA é um projeto ou código usado para fabricar proteínas. Quando o mapa ou código está errado (como as "letras" em um gene específico), ele fornece as direções erradas para sintetizar uma proteína. A proteína anormal é então incapaz de realizar seu trabalho normal. Nem todas as mutações genéticas aumentam o risco de câncer e, de fato, a maioria não aumenta. Mutações em genes responsáveis pelo crescimento e divisão de células, ou "mutações de driver" são o que impulsionam o crescimento de cânceres. Existem dois tipos principais de genes que, quando mutados, podem levar ao crescimento descontrolado conhecido como câncer:oncogenes e genes supressores de tumor.
Vários dos genes associados a um maior risco de câncer de mama são genes supressores de tumor. Esses genes codificam proteínas que funcionam para reparar danos ao DNA nas células (danos de toxinas no ambiente ou processos metabólicos normais nas células), servem para eliminar células que não podem ser reparadas ou regular o crescimento de outras maneiras. Os genes BRCA1 e BRCA2 são genes supressores de tumor.
Muitos desses genes são autossômicos recessivos, o que significa que cada pessoa herda uma cópia do gene de cada pai, e ambas as cópias devem ser mutadas para aumentar o risco de câncer. De forma simplista, isso significa que uma combinação de fatores genéticos e ambientais (uma mutação adquirida no outro gene) precisa agir em conjunto para resultar no desenvolvimento do câncer. Somado a isso, geralmente, várias mutações devem ocorrer para que uma célula se torne uma célula cancerosa.
O que significa ter uma predisposição genética para o câncer
Nem todas as mutações genéticas ou alterações genéticas aumentam o risco de câncer de mama no mesmo grau , e este é um conceito importante para quem considera o teste genético, especialmente porque muitas pessoas já ouviram falar do risco muito alto conferido pelas mutações do BRCA. A penetrância gênica é definida como a proporção de pessoas com uma mutação que experimentará a condição (neste caso, desenvolverá câncer de mama).
Para algumas mutações, o risco de câncer de mama é muito alto. Para outros, o risco pode ser aumentado apenas por um fator de 1,5. Isso é importante entender ao falar sobre possíveis opções preventivas.
Outro conceito importante para entender a genética e o câncer, embora muito complexo para explorar em detalhe aqui, é o da epigenética. Aprendemos que mudanças no DNA que não envolvem mudanças nos pares de bases (nucleotídeos) ou nas "letras" que codificam uma proteína podem ser igualmente importantes no desenvolvimento do câncer. Em outras palavras, em vez de mudanças estruturais na espinha dorsal do DNA, pode haver mudanças moleculares que alteram a forma como a mensagem é lida ou expressa.
As mutações do gene BRCA são a anormalidade genética mais conhecida associada ao câncer de mama, mas é Ficou claro que existem mulheres que estão predispostas ao câncer de mama com base em seu histórico familiar, que testam negativo.
Um estudo de 2017 descobriu que as mutações BRCA representavam apenas 9% a 29% das doenças hereditárias cânceres de mama. Mesmo quando o teste foi feito para outras 20 a 40 mutações conhecidas, no entanto, apenas 4% a 11% das mulheres deram positivo. Em outras palavras, 64% a 86% das mulheres com suspeita de câncer de mama hereditário testaram negativo para ambas as mutações BRCA e 20 a 40 outras.
Nosso conhecimento sobre mutações genéticas que aumentam o risco de câncer de mama ainda está incompleto, mas agora sabemos que existem pelo menos 72 mutações genéticas ligadas ao câncer de mama hereditário. Acredita-se que essas mutações (e outras ainda não descobertas) sejam responsáveis por 70% a 90% dos cânceres de mama hereditários que apresentam resultados negativos para mutações no gene BRCA. O acrônimo BRCAX foi cunhado para descrever essas outras mutações, representando câncer de mama familiar não relacionado a BRCA1 ou BRCA2.
72 Mutações genéticas ligadas ao câncer de mama hereditário
As anormalidades genéticas abaixo diferem em sua frequência, a quantidade de risco associado, o tipo de câncer de mama ao qual estão associados e outros cânceres associados às mutações.
A maioria desses cânceres de mama são semelhantes em características (como tipo de câncer, estrogênio- status do receptor e status HER2) para câncer de mama não hereditário ou esporádico, mas há exceções. Por exemplo, algumas mutações estão mais fortemente associadas ao câncer de mama triplo negativo, incluindo mutações em BARD1 , BRCA1 , BRCA2 , PALB2 e RAD51D .
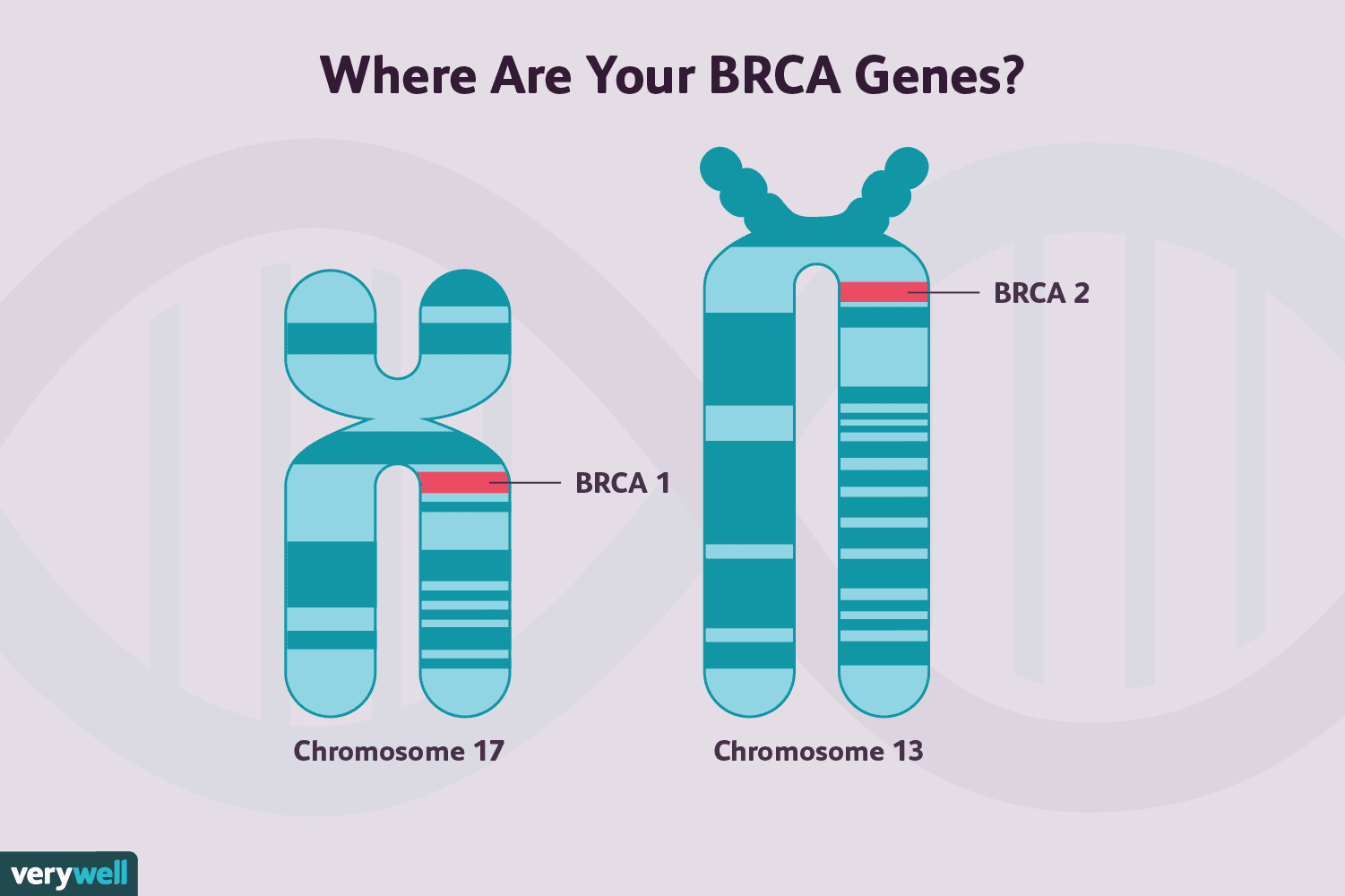
As mutações do gene BRCA 1 e as mutações do gene BRCA2 estão associadas a um risco aumentado de desenvolver câncer de mama, bem como alguns outros cânceres, embora os dois diferem um pouco nesse risco.
Em média, 72% das mulheres que têm mutações BRCA1 e 69% que têm genes BRCA2 mutados desenvolverão câncer de mama aos 80 anos.
Além disso, os cânceres de mama associados a essas mutações podem diferir. Os cânceres de mama em mulheres que têm mutações BRCA1 são mais propensos a ser triplo negativo. Cerca de 75% são negativos para o receptor de estrogênio e também são menos propensos a serem HER2 positivos. Eles também são mais propensos a ter um grau de tumor mais alto. Os cânceres de mama em mulheres com mutações BRCA2, em contraste, são semelhantes aos cânceres em mulheres que não são portadoras da mutação do gene BRCA.
O gene ATM codifica proteínas que ajudam a controlar a taxa de crescimento das células. Eles também auxiliam no reparo de células danificadas (células que sofreram danos no DNA por toxinas) ativando enzimas que reparam esses danos.
Aqueles que têm duas cópias do gene mutado têm uma síndrome autossômica recessiva incomum conhecida como ataxia Telangiectasia. Com ataxia-telangiectasia, as proteínas defeituosas não só aumentam o risco de câncer, mas resultam em algumas células do cérebro morrendo cedo demais, resultando em um distúrbio neurodegenerativo progressivo.
As pessoas que têm apenas uma cópia mutada do gene (aproximadamente 1% da população) têm um risco de 20% a 60% de desenvolver câncer de mama ao longo da vida.
Acredita-se que as pessoas que têm essa mutação estejam predispostas ao câncer de mama em idade precoce , bem como ao desenvolvimento de câncer de mama bilateral.
O rastreamento do câncer de mama com ressonância magnética da mama é recomendado a partir dos 40 anos, e as mulheres podem desejar considerar mastectomias preventivas. Pessoas com um gene ATM mutado parecem também estar predispostas a câncer de tireoide e pâncreas e são mais sensíveis à radiação.
Mutações no gene PALB2 também são uma causa importante de câncer de mama hereditário. O gene PALB2 codifica uma proteína que funciona em conjunto com a proteína BRCA2 para reparar o DNA danificado nas células. No geral, o risco de câncer de mama ao longo da vida com uma mutação PALB2 é tão alto quanto 58%, embora isso possa variar de acordo com a idade. O risco é de 8 a 9 vezes a média para mulheres com menos de 40 anos, mas cerca de 5 vezes a média para mulheres com mais de 60 anos.
Entre aqueles que carregam uma cópia do gene, 14% desenvolverão câncer de mama aos 50 anos e 35% aos 70 anos (menos do que com mutações BRCA).
Pessoas que têm uma mutação PALB2 e desenvolvem câncer de mama podem ter um risco maior de morrer da doença.
Pessoas que herdam 2 cópias do gene PALB2 mutado têm um tipo de anemia de Fanconi caracterizada por contagens muito baixas de glóbulos vermelhos, glóbulos brancos e plaquetas.
O gene CHEK2 codifica uma proteína que é ativada quando ocorre dano ao DNA. Também ativa outros genes envolvidos no reparo celular.
Os riscos ao longo da vida para portadores de mutações truncantes CHEK2 são de 20% para uma mulher sem parente afetado, 28% para uma mulher com um parente de segundo grau afetado, 34% para uma mulher com um parente de primeiro grau afetado e 44% para uma mulher com um parente de primeiro e segundo grau afetado.
Para homens e mulheres, o gene também aumenta o risco de câncer de cólon e não -Linfoma de Hodgkin.
Mutações em CDH1 causam uma condição conhecida como síndrome de câncer gástrico hereditário.
As pessoas que herdam esse gene têm um risco vitalício de até 80% de desenvolver câncer de estômago e até 52% de desenvolver câncer de mama lobular.
O gene codifica uma proteína (caderina epitelial) que ajuda as células a se unirem (uma das diferenças entre as células cancerosas e as células normais é que as células cancerosas não possuem esses produtos químicos de adesão que as fazem grudar). Cânceres em pessoas que herdam essa mutação são mais propensos a metástase.
Mutações no gene PTEN são uma das mutações mais comuns do gene supressor de tumor. O gene codifica proteínas que regulam o crescimento das células e também ajuda as células a se unirem.
Mutações no gene parecem aumentar o risco de células cancerosas se separarem de um tumor e metástase. O PTEN está associado a uma síndrome chamada síndrome do tumor de hamartoma PTEN, bem como à síndrome de Cowden.
As mulheres que carregam uma mutação PTEN têm um risco vitalício de desenvolver câncer de mama de até 85%, e também têm um risco aumentado de alterações benignas da mama, como doença fibrocística, adenose e papilomatose intraductal.
As mutações também estão associadas a um risco aumentado de câncer uterino (e miomas uterinos benignos ), câncer de tireóide, câncer de cólon, melanoma e câncer de próstata.
Sintomas não relacionados ao câncer incluem cabeça grande (macrocefalia) e tendência a formar tumores benignos conhecidos como hamartomas.
Mutações em STK11 estão associadas a uma condição genética conhecida como síndrome de Peutz-Jegher. STK11 é um gene supressor de tumor envolvido no crescimento celular.
Além de um risco aumentado de câncer de mama (com um risco vitalício de até 50%), a síndrome acarreta um risco aumentado de muitos tipos de câncer, alguns dos quais incluem câncer de cólon, câncer de pâncreas, câncer de estômago, câncer de ovário, câncer de pulmão, câncer uterino e muito mais.
As condições não relacionadas ao câncer associadas à mutação incluem pólipos não cancerosos no trato digestivo e sistema urinário, sardas no rosto e no interior da boca e muito mais. O rastreamento do câncer de mama é frequentemente recomendado para mulheres a partir dos 20 anos e, muitas vezes, com ressonância magnética com ou sem mamografias.
O gene TP53 codifica proteínas que interrompem o crescimento de células anormais.
Essas mutações são extremamente comuns no câncer, comadquiridas mutações no gene p53 sendo encontradas em cerca de 50% dos cânceres.
Mutações hereditárias são menos comuns e associadas a condições conhecidas como síndrome de Li-Fraumeni, ou Síndrome do tipo Li-Fraumeni (que tem um risco menor de câncer). A maioria das pessoas que herdam a mutação desenvolve câncer aos 60 anos e, além do câncer de mama, são propensas a desenvolver câncer ósseo, câncer adrenal, câncer pancreático, câncer de cólon, câncer de fígado, tumores cerebrais, leucemia e muito mais. Não é incomum que pessoas com a mutação desenvolvam mais de um câncer primário.
As mutações herdadas no gene p53 são responsáveis por cerca de 1% dos casos de câncer de mama hereditário. Os cânceres de mama associados à mutação geralmente são HER2 positivos e têm alto grau de tumor.
Síndrome de Lynch ou câncer colorretal hereditário sem polipose está associado a mutações em vários genes diferentes incluindo PMS2, MLH1, MSH2, MSH6 e EPCAM.
A TPM2, em particular, tem sido associada ao dobro do risco de câncer de mama. O gene funciona como um gene supressor de tumor, codificando uma proteína que repara o DNA danificado.
Além do câncer de mama, essas mutações apresentam um alto risco de câncer de cólon , ovário, útero, estômago, fígado, vesícula biliar, intestino delgado, rim e cérebro.
Existem várias outras mutações genéticas associadas a um risco aumentado de desenvolver câncer de mama e espera-se que mais serão descobertos em um futuro próximo. Alguns deles incluem:
No momento, o teste está disponível para mutações do gene BRCA, bem como mutações ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B e TP53, com esta área prevista para expandir drasticamente no futuro próximo.
Ter esses testes disponíveis, no entanto, levanta muitas questões. Por exemplo, quem pode ter câncer de mama hereditário e quem deve ser testado? O que você deve fazer se testar positivo para um desses genes?
Idealmente, qualquer teste deve ser feito apenas com a orientação e ajuda de um conselheiro genético . Há duas razões para isso.
Uma é que pode ser devastador saber que você carrega uma mutação que pode aumentar seu risco, e a orientação de alguém que esteja ciente do manejo e triagem recomendados é inestimável.
Como observado anteriormente, algumas mutações conferem um alto risco e outras um risco muito menor. Algumas mutações podem ser mais preocupantes no início da vida (digamos, em seus 20 anos), enquanto outras podem não exigir triagem precoce. Um conselheiro genético pode ajudá-lo a aprender sobre o que é atualmente recomendado em relação à triagem de sua mutação específica, levando em consideração quaisquer outros fatores de risco que você possa ter.
A outra razão pela qual o aconselhamento genético é tão importante é que você pode ter um risco significativo de desenvolver câncer de mama, mesmo que seus testes sejam negativos. Ainda há muito a aprender, e um conselheiro genético pode ajudá-lo a analisar seu histórico familiar para ver se você pode apresentar um alto risco, apesar do teste negativo, e planejar a triagem de acordo.
Testes genéticos para câncer de mama
Assim como as pessoas diagnosticadas com câncer de mama precisam de apoio, aquelas que carregam genes que aumentam o risco precisam de suporte. Felizmente, existem organizações que se concentram especificamente em apoiar pessoas nessa situação.
Uma organização, FORCE, que é um acrônimo para Enfrentar nosso risco de câncer empoderado, oferece uma linha de ajuda, quadro de mensagens e informações para aqueles que estão enfrentando câncer hereditário.
Outras organizações e comunidades de apoio estão disponíveis para ajudar as pessoas a lidar com as decisões relacionadas a um diagnóstico de câncer de mama hereditário.
O termo "previvente" foi cunhado por FORCE para descrever pessoas que estão sobrevivendo a uma predisposição ao câncer de mama. Se esta é a situação que você está enfrentando, você não está sozinho e, usando a hashtag #previvor, você pode encontrar muitos outros no Twitter e em outras mídias sociais.
Pode ser esmagador aprender sobre as muitas mutações genéticas diferentes que aumentam o risco de câncer de mama além das mutações BRCA, mas essas "outras" mutações são de importância significativa, sabendo que as mutações BRCA são responsáveis por uma minoria relativa de cânceres de mama familiares. Ao mesmo tempo, a ciência que estuda o câncer de mama hereditário ainda está engatinhando e há muito a aprender. Se você está preocupado que pode ter uma mutação ou aprendeu que tem, é útil aprender o máximo que puder. Organizações de câncer hereditário, como a FORCE, podem não apenas fornecer mais informações, mas também ajudá-lo a se conectar com outras pessoas que estão enfrentando uma jornada com perguntas e preocupações semelhantes.
 Qual a gravidade da esteato-hepatite não alcoólica?
Qual a gravidade da esteato-hepatite não alcoólica?
 Intoxicação alimentar
Intoxicação alimentar
 Cálculos renais:sintomas, causas e tratamento
Cálculos renais:sintomas, causas e tratamento
 Micróbios podem predizer resultados fatais em pacientes ventilados com COVID-19
Micróbios podem predizer resultados fatais em pacientes ventilados com COVID-19
 Você faz parte da epidemia de doenças digestivas? (e o que fazer sobre isso)
Você faz parte da epidemia de doenças digestivas? (e o que fazer sobre isso)
 Hérnia (hérnia abdominal) 9 tipos, sintomas, causas e cirurgia
Hérnia (hérnia abdominal) 9 tipos, sintomas, causas e cirurgia
 Devo tomar vinagre de maçã para a saúde intestinal?
Olá a todos! Adivinha. Hoje, tenho uma aluna que co-escreveu (ok – quase inteiramente escreveu!) no meu blog – a INCRÍVEL, Amy Pun da Universidade de Alberta. Ela é uma pesquisadora extraordinária e
Devo tomar vinagre de maçã para a saúde intestinal?
Olá a todos! Adivinha. Hoje, tenho uma aluna que co-escreveu (ok – quase inteiramente escreveu!) no meu blog – a INCRÍVEL, Amy Pun da Universidade de Alberta. Ela é uma pesquisadora extraordinária e
 Os cálculos biliares podem desaparecer sozinhos?
O que é a vesícula biliar? Alguns cálculos biliares podem se dissolver e desaparecer com a intervenção, enquanto outros precisam de um tratamento mais extenso. A vesícula biliar é um pequeno órgão
Os cálculos biliares podem desaparecer sozinhos?
O que é a vesícula biliar? Alguns cálculos biliares podem se dissolver e desaparecer com a intervenção, enquanto outros precisam de um tratamento mais extenso. A vesícula biliar é um pequeno órgão
 Nova estratégia pode fortalecer a comunicação cérebro-intestino
O sistema de comunicação entre o intestino e o cérebro é conhecido como eixo intestino-cérebro e está bem estabelecido. Agora, os cientistas desenvolveram uma estratégia que aumenta o volume da comuni
Nova estratégia pode fortalecer a comunicação cérebro-intestino
O sistema de comunicação entre o intestino e o cérebro é conhecido como eixo intestino-cérebro e está bem estabelecido. Agora, os cientistas desenvolveram uma estratégia que aumenta o volume da comuni